Журнал учёта вакцин — Справочная система «М-АПТЕКА плюс от АйТи-Аптека»
Учёт товарных запасов → Отчёты, справки → Заведующий отделом → Журнал учёта вакцин.
Данный отчёт может быть использован для учёта медицинских иммунобиологических препаратов, а также в других целях. Фактически, это отчёт по фармгруппам, часть которых относится к группе вакцин.
Отнесение конкретных препаратов к вакцинам выполняется в форме Привязка товара к фармгруппам.
Примечание
Данный журнал является журналом регистрации движения МИБП и называется Журнал учёта поступления и расхода вакцины.
Внимание
В соответствии с пунктом 5.1 Санитарно-эпидемиологических правил «Санитарно-эпидемиологические требования к условиям транспортировки, хранению и отпуску гражданам медицинских иммунобиологических препаратов, используемых для иммунопрофилактики, аптечными учреждениями и учреждениями здравоохранения» СП 3.3.2.1120-02 (в ред. от 18. 02.2008) аптечные учреждения, осуществляющие отпуск МИБП гражданам, должны вести учёт поступления и расхода МИБП. При этом указывается, что в аптечной организации для этого должен быть в наличии журнал учёта поступления и расхода МИБП.
02.2008) аптечные учреждения, осуществляющие отпуск МИБП гражданам, должны вести учёт поступления и расхода МИБП. При этом указывается, что в аптечной организации для этого должен быть в наличии журнал учёта поступления и расхода МИБП.
Форма журнала учёта приведена в Приложении № 1 к Правилам только для вакцин. При этом в Правилах не оговорено, что порядок учёта для разных групп медицинских иммунобиологических препаратов может или должен быть различным. Поэтому учёт любых МИБП, поступающих в аптечную организацию в программе «М-АПТЕКА плюс», ведётся в единственной разработанной для этого форме, установленной в Приложении № 1 к Правилам.
Форма окна предварительных настроек отчёта представлена ниже:
В отчёте можно выбрать
Примечание
В блоках Подразделения и Фармгруппы существует возможность отметить сразу всё, или же снять отметку со всех значений, входящих в тот или иной блок.
Отчёт формируется исходя из следующих группировок списков документов в Настройках для отчётов, расположенных по адресу: Администратор системы → Настройки системы → Системные настройки → Прикладные настройки → Настройки для отчётов:
- Документы движения товара.
- Документы оптовой продажи.
- Документы прочего расхода.
- Документы перемещение (Склад).
- Документы розничной реализации.
- Документы прихода от поставщика.
- Документы передачи.
- Документы возврата.
- Документы возврата (Склад).
- Документы возврата покупателя.
- Документы реализации по безналичному расходу.
- Документы реализации за наличные.
- Документы возврата поставщику.
Состав отчёта
- Наименование – наименование товара по Справочнику товаров.
Приходная часть
Дата получения, Номер документа

Производитель – страна и фирма-производитель по конкретной партии товара. Может быть не заполнено, если в приходной накладной не введено значение.
Поставщик – фирма-поставщик по конкретной партии товара. Может быть не заполнено, если в приходной накладной не введено значение.
Серия, контрольный номер – серия конкретной партии товара. Может быть не заполнено, если в приходной накладной не введено значение.
Срок годности – срок годности конкретной партии товара. Может быть не заполнено, если в приходной накладной не введено значение.
Производитель – страна и фирма производитель по конкретной партии товара. Может быть не заполнено, если в приходной накладной не введено значение.
Количество доз/фасовка – поступившее количество препарата по документу.
Тип и контрольный номер термоиндикатора – текстовое поле, содержащее информацию о типе термоиндикатора и его номер.

Показания термоиндикатора – температура, отображающаяся на термоиндикаторе (+5°С, — 8°С, 0°С).
Примечание
- Для вновь приходуемых товаров это поле заполняется вручную в процессе предпродажной обработки (см. Предпродажная проверка товара).
- Для уже оприходованных товаров, для которых это поле в своё время не было заполнено, оно может быть введено при редактировании атрибута партии Показания термоиндикатора для МИБП (см. Наличие товаров в отделе. Дополнительные возможности таблицы партий → Наиболее часто используемые функции →
Расходная часть
Дата отпуска – дата расходного документа (поле Дата документа в документе) и внутренний номер документа.

Кому отпущено – поле заполняется получателем товара. Причём если известен конкретный получатель товара (например, наименование организации) то выводится наименование организации, если получатель неизвестен (например, розничная реализация), выводится тип документа.
Количество доз/фасовка – отпущенное количество препарата по документу.
Остаток (доз) – количество препарата, оставшегося в наличии.
Тип и контрольный номер термоиндикатора – текстовое поле, содержащее информацию о типе термоиндикатора и его номер. (Типы термоиндикаторов: термохимические, электронные, жидкокристаллические, люминесцентные и так далее). Номер термоиндикатора – текстовое поле, например, ТХ-123/7 или 0492852).
Показания термоиндикатора – температура, отображающаяся на термоиндикаторе (+5 °С, — 8°С, 0 °С).
Пример построенного отчёта «Журнал учёта вакцин»
Сформированный отчёт можно сохранить и экспортировать в файл в виде электронной таблицы с помощью универсального программного механизма, см.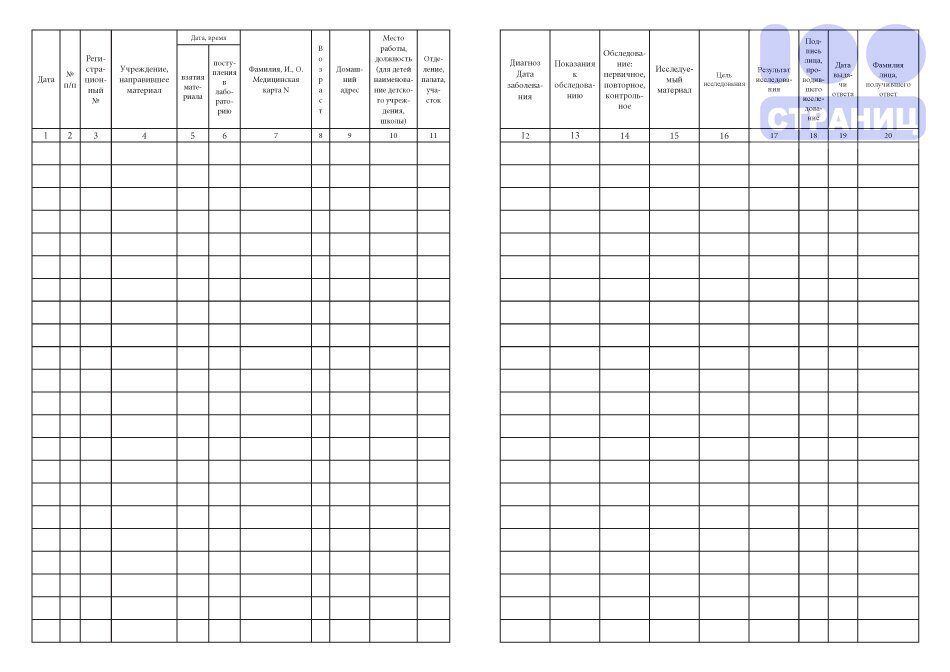 Экспорт отчётов в Excel.
Экспорт отчётов в Excel.
Схожую информацию позволяет получить отчёт Журнал №6 (учётные медикаменты).
Примерная форма журнала регистрации движения медицинских иммунобиологических препаратов (мибп) из мибп, примерная форма журнала
- Указатель
И поиск - Новые формы (Учет|Налоги|КНД
ОКУД|КФД|КБК|СФР|Кадры) - Нотариусы
Москвы - Регионы
Города - ГОСТы
И СНиПы - Новости
- Статьи
- О проекте
- Друзья и партнеры
- Наша новинка
- Наш поиск
- Яндекс поиск
- Гугл поиск
- Гороскоп
- Игра для умников
Добавили несколько тысяч ГОСТов
ГОСТы по-новому, с постраничной удобной навигацией для ознакомления
МИБП — основная группа документов в которую входит документ, другие группы в которые входит документ, похожие документы
Журналы, Формы, Врачи и пациенты — разделы в которые входит документ, все разделы документов
Примерная форма журнала регистрации движения медицинских иммунобиологических препаратов (мибп)
Скачать в MS Word docx
Редактировать документ
Подписывайтесь на наш Youtube канал!
Подписывайтесь на наш Telegram канал!
Гороскоп (бизнес/феншуй) Бланки новых документов, актуальных с 2023 года и производственный календарь 2023 Новые категории на нашем портале Трудовой кодекс ( ТК ) бланки документов
Читайте статьиКрипта #прожиточныйминимум#производственныйкалендарь#пособие#социальноевидео
7 документовМИБП15 документовПримерная форма журнала664 документовПримерная форма1820 документовПример документа2558 документовМедицина4042 документовЖурнал20000 документовФорма
Рекомендуем документы
Примерная форма жалобы в вышестоящий налоговый орган на решение о привлечении к ответственности за совершение налогового правонарушения (вынесенное по результатам налоговой проверки)Примерная форма жалобы на решение о привлечении к ответственности за совершение налогового правонарушения (вынесенное по результатам налоговой проверки)Примерная форма жалобы на решение о привлечении лица к ответственности за налоговое правонарушение (вынесенное по результатам иного мероприятия налогового контроля)Примерная форма журнала государственного учета установок очистки газаПримерная форма журнала обработки исходных данных по искривлению скважин и их обработка для определения зоны вероятной встречи скважины при отсутствии замеров ее искривленияПримерная форма журнала регистрации движения медицинских иммунобиологических препаратов (мибп)Примерная форма журнала регистрации дефектов объектов дорожного хозяйства улично-дорожной сети города москвы и учета работ по их устранениюПримерная форма журнала регистрации разрешения на производство земляных работПримерная форма журнала технического обслуживания линейно кабельных сооружений сельских телефонныхПримерная форма журнала технического обслуживания линейно-кабельных сооружений сельских телефонных сетейПримерная форма журнала технического осмотра линейно-кабельных сооружений местных сетей связи
Акты Банкротство физлиц Библиотека Ведомости Врачи и пациенты ГИБДД, жалобы ГОСТы и СНиПы Доверенности Договоры Договоры аренды Договоры залога Договоры купли-продажи Договоры по алфавиту Жалобы ЖКХ Журналы Заключения Запросы Защита бизнеса Защита прав потребителя Заявки Заявления Инвестиции Иски, претензии к договорам Исковые заявления ИТ. Интернет Карточки КБК 2023 Контроль, проверки и экспертизы Листы Миграционное право Недвижимость Органы государственной власти Отчеты Охота, рыболовство и спорт Положения Пособия и пенсии Постановления Претензии Приказы Протоколы Профессиональные стандарты Расторжение договора Расчеты Решения (не судебные) Сведения Сельское хозяйство Семейное право. Алименты, наследство, дарение Соглашения Справки Страхование Строительство Таможня Транспорт Трудовое право. ТК РФ, отдел кадров Трудовые договоры и должностные инструкции ТЭК Уведомления и Извещения Унифицированные формы Формы Формы банковских документов Формы бухгалтерской отчетности Формы налоговой отчетности Формы открытия/изменения бизнеса, ИП/ООО, типовые уставы ООО (36 штук) Формы первичных учетных документов Ходатайства Юристам
Интернет Карточки КБК 2023 Контроль, проверки и экспертизы Листы Миграционное право Недвижимость Органы государственной власти Отчеты Охота, рыболовство и спорт Положения Пособия и пенсии Постановления Претензии Приказы Протоколы Профессиональные стандарты Расторжение договора Расчеты Решения (не судебные) Сведения Сельское хозяйство Семейное право. Алименты, наследство, дарение Соглашения Справки Страхование Строительство Таможня Транспорт Трудовое право. ТК РФ, отдел кадров Трудовые договоры и должностные инструкции ТЭК Уведомления и Извещения Унифицированные формы Формы Формы банковских документов Формы бухгалтерской отчетности Формы налоговой отчетности Формы открытия/изменения бизнеса, ИП/ООО, типовые уставы ООО (36 штук) Формы первичных учетных документов Ходатайства Юристам
Алфавитный указатель
П — группы документов на букву ‘П’Ф — группы документов на букву ‘Ф’Ж — группы документов на букву ‘Ж’Р — группы документов на букву ‘Р’Ячейка бибилиотеки документов
3015 — ячейка
youtube.com/embed/dlkhNpFIFJM» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»><перейти в начало документа>
<скачать бесплатно документ 2023>
Фундаментальные и прикладные науки: технологии и иммунобиологические препараты
Обсуждается опыт организации создания инновационных иммунобиологических препаратов и вакцин – от лабораторных разработок до промышленных технологий и регистрации готовых форм эффективных и безопасных препаратов, востребованных в внутреннем и внешнем рынках. Принципы их действия основаны на последних мировых достижениях в области иммунобиологии и вакцинологии.
Ключевые слова: технология разработки вакцин, инфекционный агент, коронавирусная инфекция
Вакцинация рассматривается как один из основных методов обеспечения здоровья любого человека любой социальной группы в развитых и развивающихся странах. Общепризнано, что вакцины снижают детскую смертность, увеличивают продолжительность жизни и способствуют активному долголетию. За последние десятилетия мировая и отечественная иммунология добилась значительных успехов в профилактике инфекционных заболеваний за счет национальных программ иммунизации. Всего в мире проводится вакцинация против более 30 различных заболеваний, что позволило добиться значительного снижения детской и младенческой смертности, остановить или приблизиться к полной ликвидации эпидемической угрозы от многих болезней. Вакцины, произведенные по классическим технологиям, достаточно успешно справляются с проблемами, которые ранее считались угрозой национальной эпидемической безопасности. В то же время, по мере того как эти угрозы исчезают, возникают другие трудности. Например, проблемой является негативное отношение к вакцинации со стороны больших групп населения и даже некоторых врачей. Предлогом для этого являются побочные эффекты, которые действительно существуют у некоторых вакцин.
Общепризнано, что вакцины снижают детскую смертность, увеличивают продолжительность жизни и способствуют активному долголетию. За последние десятилетия мировая и отечественная иммунология добилась значительных успехов в профилактике инфекционных заболеваний за счет национальных программ иммунизации. Всего в мире проводится вакцинация против более 30 различных заболеваний, что позволило добиться значительного снижения детской и младенческой смертности, остановить или приблизиться к полной ликвидации эпидемической угрозы от многих болезней. Вакцины, произведенные по классическим технологиям, достаточно успешно справляются с проблемами, которые ранее считались угрозой национальной эпидемической безопасности. В то же время, по мере того как эти угрозы исчезают, возникают другие трудности. Например, проблемой является негативное отношение к вакцинации со стороны больших групп населения и даже некоторых врачей. Предлогом для этого являются побочные эффекты, которые действительно существуют у некоторых вакцин. Поэтому важно уделять особое внимание совершенствованию технологий производства вакцин для снижения их реактогенности и других побочных эффектов.
Поэтому важно уделять особое внимание совершенствованию технологий производства вакцин для снижения их реактогенности и других побочных эффектов.
Продолжается совершенствование технологий производства вакцин; ученые отказываются от использования животных и эмбрионов в пользу культивирования вирусов в клеточных средах. Помимо избежания этических проблем, это позволяет минимизировать количество аллергических реакций за счет уменьшения количества чужеродных белков в препарате и стандартизации его состава. Исследования также движутся в направлении использования генно-инженерных композиций, содержащих не полный антиген, а фрагменты, достаточные для индукции антител, но лишенные патогенных свойств вируса как такового, что значительно снижает частоту побочных эффектов. Разрабатываются РНК- и ДНК-вакцины, потенциально способные решить проблемы безопасности и эффективности производства препаратов против особо опасных и плохо культивируемых возбудителей. Широко применяются поликомпонентные вакцины, позволяющие проводить вакцинацию сразу против нескольких возбудителей [1].
Вирусологи и инфекционисты начинают обращать внимание на негативные последствия, в том числе отсроченные, тех инфекций, которые ранее отходили на второй план на фоне более тяжелых заболеваний и не считались существенной угрозой, например, ротавирусы и куриные оспа Однако значительное повышение стандартов здравоохранения делает необходимым углубленное изучение этих инфекций и выявление их реального влияния на заболеваемость и смертность, в том числе детскую, а также отдаленные последствия перенесенных заболеваний и угрозу взрослому населению. у которых нет к ним иммунитета, а также расширить номенклатуру наименований национальных календарей прививок. Для взрослых, как известно, такие инфекции могут представлять опасность совсем другого уровня, чем для детей. Поэтому необходимо создать и освоить производство новых вакцин против возбудителей, ранее не считавшихся заслуживающими серьезного внимания, и включить их в национальные календари. За рубежом такая работа давно и активно ведется, в то время как отечественная промышленность уделяет этой проблеме мало внимания. Отставание в области инновационных профилактических и лечебных иммунобиологических препаратов может привести к формированию практически полной зависимости от зарубежных производителей при использовании инновационных методов лечения и профилактики массовых и социально значимых заболеваний — от инфекционных до онкологических.
Отставание в области инновационных профилактических и лечебных иммунобиологических препаратов может привести к формированию практически полной зависимости от зарубежных производителей при использовании инновационных методов лечения и профилактики массовых и социально значимых заболеваний — от инфекционных до онкологических.
Поскольку количество вновь открываемых вирусов растет, со временем вакцинация будет возможна только в виде комплексных вакцин сразу против нескольких инфекционных агентов. Синтез вирусного генома позволяет гарантировать его состав и генетическую однородность. Кроме того, существуют способы аттенуации (ослабления) вирусов, которые реализуются с помощью, в том числе, геномных модификаций.
За последние несколько десятилетий технологии разработки вакцин претерпели значительные изменения благодаря лучшему пониманию механизмов функционирования иммунной системы человека в борьбе с инфекционными агентами и злокачественными опухолями. Наряду с профилактическими вакцинами, эффективность и безопасность которых значительно повышаются за счет использования новых технологий, появились и находят все большее применение лечебные вакцины.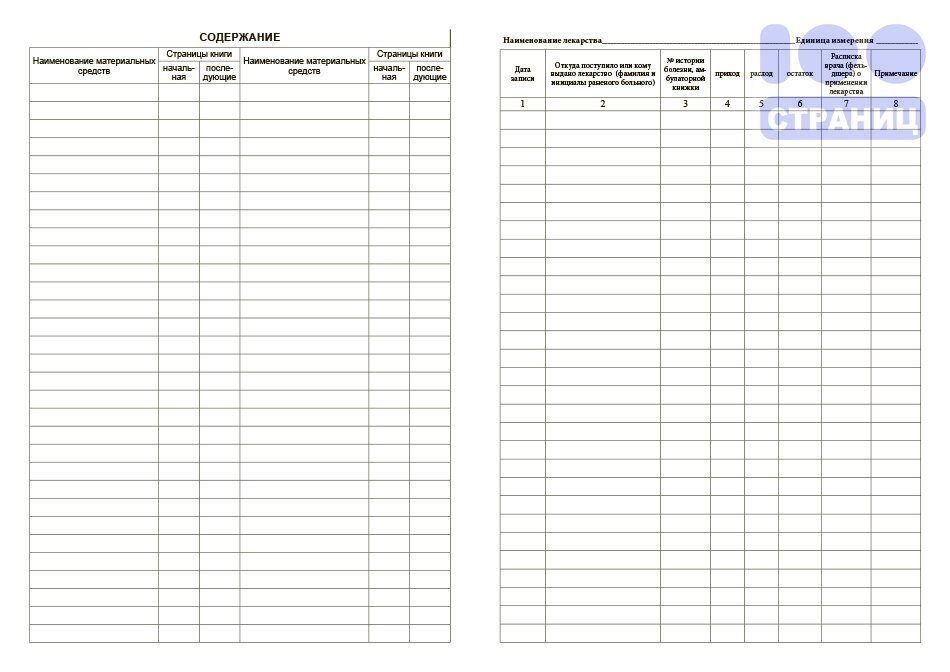 На основе знаний о механизмах взаимодействия иммунной системы и вирусов появились препараты генной терапии, использующие вирусы в качестве векторов.
На основе знаний о механизмах взаимодействия иммунной системы и вирусов появились препараты генной терапии, использующие вирусы в качестве векторов.
Иммунобиология начинает использоваться в онкологии. Активно развивается направление, использующее уязвимость ряда раковых клеток к вирусу [2]. Технология лечения заключается в селекции минимально патогенного штамма вируса (например, реовируса, ротавируса, модифицированного вируса оспы, вируса Коксаки) для использования в качестве агента, вызывающего лизис (разрушение) опухоли. Ведется научная работа в направлении поиска механизмов и выявления закономерностей уязвимости опухолей различной этиологии и подбора штаммов и методов использования онколитических вирусов, а также технологий их промышленного получения. Первые исследования показали, что в ряде случаев выживаемость больных без опухолевой прогрессии (при прекращении лечения) удваивается, а общая выживаемость у части больных может быть увеличена в 3–4 раза [3].
Федеральный научный центр исследований и разработок иммунобиологических препаратов имени Чумакова РАН – ведущий научный центр в области медицинской вирусологии, в том числе по изучению полиомиелита; клещевой энцефалит; вирусные геморрагические лихорадки; грипп; и энтеровирусные, арбовирусные и коронавирусные инфекции. Проводит фундаментальные и прикладные, в том числе клинические, исследования и разрабатывает научные основы создания профилактических и диагностических лекарственных средств, теоретически обосновывает стратегии профилактики инфекционных заболеваний и изучает вопросы обеспечения биобезопасности окружающей среды. Интеллектуальный и технический потенциал центра позволяет осуществлять полный цикл работ (от создания концепции лекарственного препарата и лабораторных исследований до технологии изготовления готовых лекарственных форм) и организовывать и контролировать необходимый объем доклинических исследований. и клинических исследований, а также процесс регистрации лекарственных средств, в том числе на зарубежных рынках.
Проводит фундаментальные и прикладные, в том числе клинические, исследования и разрабатывает научные основы создания профилактических и диагностических лекарственных средств, теоретически обосновывает стратегии профилактики инфекционных заболеваний и изучает вопросы обеспечения биобезопасности окружающей среды. Интеллектуальный и технический потенциал центра позволяет осуществлять полный цикл работ (от создания концепции лекарственного препарата и лабораторных исследований до технологии изготовления готовых лекарственных форм) и организовывать и контролировать необходимый объем доклинических исследований. и клинических исследований, а также процесс регистрации лекарственных средств, в том числе на зарубежных рынках.
Основными направлениями фундаментальных исследований Центра Чумакова являются:
• изучение биологии вирусов, вызывающих инфекционные заболевания высокой социальной значимости, и их взаимодействия с хозяином на молекулярном, клеточном, организменном и популяционном уровнях [4];
• изучение механизмов изменчивости РНК-содержащих вирусов на основе анализа материалов от больных, животных и объектов внешней среды, а также экспериментальных модельных исследований [5];
• экспериментальное изучение вирус-клеточного взаимодействия и молекулярных основ патогенеза и формирования иммунного ответа при вирусных заболеваниях [6];
• изучение факторов, определяющих эпидемиологическую и эпизоотологическую ситуацию по вирусным инфекциям с различными путями распространения и разработка научно обоснованного сценария изменения ситуации в зависимости от внешних воздействий [7, 8];
• изучение структурно-функциональной организации паразитарных систем в природных очагах новых и рецидивирующих инфекций, а также механизмов заноса возбудителей на территорию России и предотвращения их распространения [9]. ].
].
Технологические решения прикладных научных задач Центра Чумакова включают:
• разработка биотехнологических основ создания иммунобиологических препаратов, включая выделение и идентификацию вирусов (с использованием физико-химических, биологических, иммунологических, молекулярных и электронно-микроскопических методов ), изучение спектра культур клеток, чувствительных к размножению вирусов, аттестация вакцинных штаммов вирусов, определение ареала лабораторных животных как биологической модели для изучения клинико-иммунологических проявлений инфекции, оптимизация культивирования вирусов для получения высокоэффективных активный субстрат, фильтрация вируссодержащей жидкости, концентрирование вируссодержащей жидкости (ультрафильтрация в тангенциальном потоке), очистка вируссодержащего концентрата (гель-хроматография), инактивация формалином или бета-пропиолактоном;
• разработка методов контроля качества вакцин;
• доклинические исследования вакцины;
• эпидемиологический мониторинг известных и возникающих инфекций.
Схема биотехнологической платформы для цельновирионных вакцин представлена на рис. Вакцинные препараты производства Центра профилактики вирусных заболеваний имени Чумакова представлены на рис. Основной продукцией центра являются противовирусные вакцины против бешенства, клещевого энцефалита и желтой лихорадки, а также оральные полиовакцины, созданные за последние пять лет, в том числе моновалентный препарат МоноВакПолио (на основе аттенуированных полиовирусов Сэбина 1, 2, 3 серотипа) и бивалентный препарат BiVacPolio (на основе полиовируса Сэбина 1 и 3 серотипов). Кроме того, впервые в России зарегистрирована и готова к промышленному производству инактивированная вакцина против полиомиелита из аттенуированных вирусов Сэбина трех серотипов «ПолиовакСин».
Открыть в отдельном окне
Биотехнологическая платформа для цельновирионных вакцин.
Открыть в отдельном окне
Вакцинные препараты производства ФНЦ им. Чумакова НИИ ИБФ РАН.
В связи с пандемией инфекции COVID-19 была разработана технология изготовления инактивированной цельновирионной вакцины CoviVac и освоено ее крупносерийное производство [10].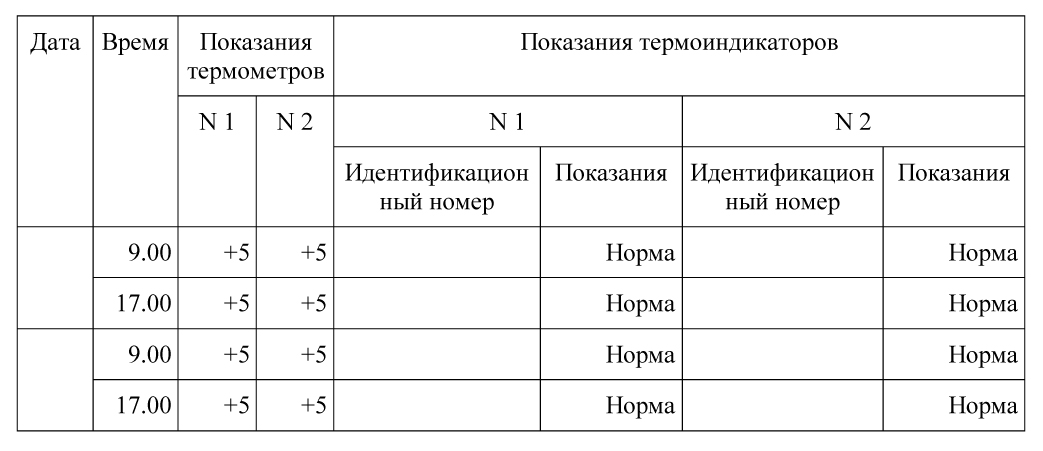 К настоящему времени успешно прошла доклинические исследования двухвалентная цельновирионная инактивированная вакцина ГЛПС-Вак для профилактики геморрагической лихорадки с почечным синдромом, не имеющая аналогов в мире [11].
К настоящему времени успешно прошла доклинические исследования двухвалентная цельновирионная инактивированная вакцина ГЛПС-Вак для профилактики геморрагической лихорадки с почечным синдромом, не имеющая аналогов в мире [11].
Перспективы технологических решений в производстве вакцин в Центре Чумакова следующие.
• Разработка инактивированной коронавирусной вакцины на основе новых штаммов: CoviVac-Delta, CoviVac-Combi и Комбинированной вакцины против коронавируса и гриппа.
• Вакцина против полиомиелита на основе вирусоподобных частиц растений. Для разработки этой технологии были получены и модифицированы гены капсидных белков полиовируса. Для экспрессии вирусоподобных частиц полиовируса в растениях созданы генно-инженерные конструкции на основе различных векторов. Разработаны способы доставки конструкций к клеткам-продуцентам, а также основные способы выделения и детекции вирусоподобных частиц в растениях и способы выращивания растений в условиях аэропонной установки для экспрессии вирусоподобных частиц. В ближайшее время будет отработана экспрессия вирусных белков и вирусоподобных частиц в растениях в условиях фитотрона и проанализирована эффективность их экспрессии в различных условиях.
В ближайшее время будет отработана экспрессия вирусных белков и вирусоподобных частиц в растениях в условиях фитотрона и проанализирована эффективность их экспрессии в различных условиях.
• Вакцина против COVID-19 на основе вирусоподобных частиц в клетках насекомых, для разработки технологии которой выделены гены капсидных белков из вакцинного штамма АЙДАР-1. Получены донорные плазмиды и рекомбинантные бакмиды для экспрессии капсидных белков. Получены рекомбинантные бакуловирусы, несущие гены S и N. Разработана технология культивирования клеток насекомых Sf9 в лабораторных условиях. Были экспрессированы оболочечные белки SARS-CoV-2 Spike и N. В ближайшее время будут получены рекомбинантные бакуловирусы, несущие гены М и Е SARS-CoV-2. Будут подобраны условия коэкспрессии генов оболочки SARS-CoV-2 для получения вирусоподобных частиц и разработана технология очистки вирусоподобных частиц.
Учитывая новые знания, биотехнологам следует делать ставку на разработку инновационных вакцин на основе последних достижений вакцинологии с использованием передовых систем и подходов, объединяющих такие направления, как геномика, транскриптомика, протеомика и др. Необходимо активно отходить от традиционных методов создание вакцин к современным, направленное на повышение стабильности вакцин и улучшение их состава и способов доставки. Невнимание к этой тенденции может привести (и уже приводит) к постепенному «вымыванию» отечественного ассортимента вакцин западными аналогами, произведенными по более современным технологиям, которые в том числе и продвигаются, исходя из мнения ВОЗ. .
Необходимо активно отходить от традиционных методов создание вакцин к современным, направленное на повышение стабильности вакцин и улучшение их состава и способов доставки. Невнимание к этой тенденции может привести (и уже приводит) к постепенному «вымыванию» отечественного ассортимента вакцин западными аналогами, произведенными по более современным технологиям, которые в том числе и продвигаются, исходя из мнения ВОЗ. .
Автор заявляет об отсутствии конфликта интересов.
Академик РАН Айдар Айратович Ишмухаметов – директор ФНЦ им. Чумакова ИБФ РАН.
Перевод Алексеева Б.
1. Михеева И.В., Акимова Ю.В. И., Михеева М. А. Внедрение пентавалентной вакцины DTaP/IPV/Hib в национальный календарь прививок. Педиатр. Фармакол. 2019;16:171–179. doi: 10.15690/pf.v16i3.2030. [CrossRef] [Google Scholar]
2. Чумаков П. М. Могут ли онколитические вирусы обеспечить прорыв в онкологии? Вестник Руси. акад. науч. 2019;89:171–178. doi: 10.1134/S101933161
23. [CrossRef] [Google Scholar]
3. Desjardins A., Gromeier M., Herndon J.E. Рецидивирующая глиобластома, леченная рекомбинантным полиовирусом. Н. англ. Дж. Мед. 2018; 379: 150–161. doi: 10.1056/NEJMoa1716435. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Desjardins A., Gromeier M., Herndon J.E. Рецидивирующая глиобластома, леченная рекомбинантным полиовирусом. Н. англ. Дж. Мед. 2018; 379: 150–161. doi: 10.1056/NEJMoa1716435. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
4. Постникова Ю., Трещалина А., Боравлева Е. Разнообразие и скорость реассортации вирусов гриппа А у диких уток и чаек. Вирусы. 2021;13:1010. doi: 10.3390/v13061010. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
5. Трещалина А., Постникова Ю., Боравлева Е. Замена Arg140Gly в гемагглютинине снижает вирулентность высокопатогенного вируса птичьего гриппа H7N1. Вирусы. 2021;13:1584. doi: 10.3390/v13081584. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
6. Козловская Л. И., Пиняева А. Н., Игнатьев Г. М. Долгосрочная гуморальная иммуногенность, безопасность и защитная эффективность инактивированной вакцины против COVID-19 (CoviVac) в доклинических исследованиях исследования. Эмердж. микробы заражают. 2021;10:1790–1806. doi: 10.1080/22221751.2021.1971569. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
doi: 10.1080/22221751.2021.1971569. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
7. Иванова О.Е. Полиомиелит в современных условиях: Достижения и перспективы. Дж. Инфектол. 2018;10:17–29. doi: 10.22625/2072-6732-2018-10-2-17-29. [CrossRef] [Google Scholar]
8. Холодилов И. С., Белова О. А., Морозкин Е. С. Географическое и клещевое распространение флавиподобных вирусов клещей Аонгшан и Янгоу в России. Вирусы. 2021;13:458. doi: 10.3390/v13030458. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
9. Ткаченко Е.А., Ишмухаметов А.А., Дзагурова Т.К. и др. Геморрагическая лихорадка с почечным синдромом, Россия. Заразить. Дис. 12 , 2325–2328 (2019). [PubMed free article] [PubMed]
10. Пиняева А., Игнатьев Г., Козловская Л. Иммуногенность и безопасность инактивированной вакцины против полиомиелита штамма Сэбина «ПолиовакСин»: клинические испытания фазы I и II. Вакцина. 2021;9:565. doi: 10.3390/vaccines9060565. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
11. Дзагурова Т.К., Синюгина А.А., Ишмухаметов А.А. и др. Доклинические исследования инактивированной поливалентной вакцины против ГЛПС // Фронт. Клетка. Заразить. микробиол. 10 , 545372 (2020). [ОНК бесплатная статья] [PubMed]
Дзагурова Т.К., Синюгина А.А., Ишмухаметов А.А. и др. Доклинические исследования инактивированной поливалентной вакцины против ГЛПС // Фронт. Клетка. Заразить. микробиол. 10 , 545372 (2020). [ОНК бесплатная статья] [PubMed]
Общая информация :Держлікслужба
Департамент контроля качества лекарственных средств Государственной службы Украины по лекарственным средствам и контролю за наркотиками (далее — Департамент) руководствуется Конституцией Украины, законы Украины, постановления Верховной Рады Украины, акты Президента Украины, Кабинета Министров Украины, другие нормативные правовые акты, Положение о Государственной службе по лекарственным средствам и контролю за оборотом лекарственных средств, ее приказы, Положение о Департамент контроля качества лекарственных средств (далее — Положение), а также документы системы менеджмента качества Государственной службы Украины по лекарственным средствам и контролю за лекарственными средствами.
Департамент в соответствии с Положением выполняет следующие основные функции:
Участвует в разработке и обсуждении проектов нормативных правовых актов по вопросам, относящимся к компетенции Департамента.
Готовит решение (распоряжение) Государственной службы о запрещении (прекращении) производства, реализации (торговли), хранения и применения лекарственных средств, не соответствующих требованиям, установленным нормативными актами и нормативными документами, в том числе в отношении которых уведомления о непредвиденных побочных эффектов не было. реакции и/или смерть человека в результате применения набора или серии лекарственных средств для расследования их причин.
Осуществляет контроль за деятельностью территориальных органов государственной службы в пределах компетенции Департамента в части соблюдения требований законодательства Украины об обеспечении качества лекарственных средств, в том числе законодательства об административных правонарушениях.
Разрабатывает и совершенствует механизм взаимодействия с территориальными органами Государственной службы по вопросам, отнесенным к компетенции Департамента.
Обеспечивает государственный контроль за качеством лекарственных средств для обеспечения качества и безопасности лекарственных средств, в том числе закупаемых за государственный и местный бюджеты, на всех этапах лечения.
Совместно с другими структурными подразделениями Государственная служба готовит материалы и участвует в организации постоянно действующих обучающих семинаров для инспекторов, сотрудников лабораторий, оптовых поставщиков лекарственных средств, дистрибьюторов, провизоров по вопросам, входящим в компетенцию Департамента.
Обеспечивает осуществление государственного контроля лекарственных средств при их ввозе на таможенную территорию Украины.
В рамках компетенции Департамента Департамент разрабатывает и вносит предложения по совершенствованию механизма взаимодействия с производителями (представительствами иностранных производителей) лекарственных средств для оперативного выявления некачественных, контрафактных и незарегистрированных лекарственных средств.
Обобщает и подготавливает материалы для заседаний коллегии, совещаний, семинаров, о состоянии контроля качества лекарственных средств, находящихся в обращении.
Осуществляет анализ показателей работы территориальных органов государственной службы по вопросам, входящим в компетенцию Департамента.
Контролирует деятельность территориальных органов государственной службы и подведомственных им лабораторий в пределах компетенции Департамента по вопросам обеспечения качества лекарственных средств, в том числе законодательства об административных правонарушениях.
Разрабатывает формы учета работы и отчетности территориальных органов государственной медицинской службы, а также лабораторий контроля качества лекарственных средств, по вопросам, отнесенным к компетенции Управления.
Организует и проводит работу по признанию в установленном порядке лабораторий, уполномоченных Государственной службой на выполнение работ по контролю качества лекарственных средств.
Обеспечивает анализ и обобщение документов по срочным сообщениям территориальных органов государственной службы о выявленных ненадлежащих, контрафактных и незарегистрированных лекарственных средствах, а также лекарственных средствах, не соответствующих требованиям, установленным нормативными документами, и подготавливает информационные бюллетени в территориальные органы Государственной службы по выявлению некачественных лекарственных средств, обнаруженных на территории Украины. .
.
Осуществляет контроль за использованием территориальными органами государственной службы для принятия мер по изъятию из обращения ненадлежащих, фальсифицированных, незарегистрированных лекарственных средств, а также лекарственных средств, не соответствующих требованиям, установленным нормативными документами, в течение компетенции отдела.
Обеспечивает осуществление государственного контроля за соблюдением требований обеспечения качества и безопасности лекарственных средств при их обращении.
Организует и обеспечивает в установленном порядке отбор медицинских изделий в целях осуществления государственного контроля за их качеством.
Систематизирует и обобщает информационную базу по вопросам некачественных, фальсифицированных, незарегистрированных медицинских изделий, а также лекарственных средств, не соответствующих требованиям, установленным нормативными документами, которые были запрещены решениями (распоряжениями) Государственного Услуга.
Рассматривает жалобы, запросы на информирование населения, обращения граждан, субъектов хозяйствования, товаропроизводителей, представительств иностранных компаний в Украине по вопросам, входящим в компетенцию Департамента.
Предоставляет информацию о жалобах, связанных с качеством лекарств.
Взаимодействует в установленном порядке с органами регулирования в сфере обращения лекарственных средств иностранных государств и международных организаций (регуляторы в сфере обращения лекарственных средств СНГ, ЕМА, ПИК/С, ВОЗ и др.) по вопросам, входящим в компетенцию Департамента.
Участвует в согласовании и выполнении обязательств, предусмотренных международными договорами, конвенциями, соглашениями, меморандумами и другими международными документами по вопросам, входящим в компетенцию Департамента.
Готовит информационные бюллетени в территориальные органы Государственной службы о выявленных контролирующими органами в сфере обращения лекарственных средств иностранных государств и международных организаций несоответствующих и контрафактных лекарственных средств.
Обеспечивает информационный обмен с правоохранительными органами по выявленным и запрещенным решениям (заказам) контрафактных лекарственных средств, а также по другим вопросам, содержащим признаки преступления.
Готовит письма об отмене решений (распоряжений) Государственной службы на основании положительных результатов дополнительных исследований для контроля их качества.
Взаимодействует в установленном порядке с другими органами исполнительной власти, вспомогательными органами и службами, установленными Президентом Украины, органами местного самоуправления, соответствующими органами иностранных государств и международных организаций, профсоюзов и организаций работодателей, а также предприятий, учреждений, организаций, по вопросам, отнесенным к компетенции Департамента.
В пределах своей компетенции участвует в подготовке отчетов о результатах государственного контроля качества лекарственных средств в Кабинет Министров Украины, Министерство здравоохранения Украины и другие органы исполнительной власти (по запросу).
Готовит предложения по формированию государственной политики в области аттестации лабораторий контроля качества и безопасности лекарственных средств, совершенствования системы контроля качества лекарственных средств, участвует в реализации указанной государственной политики.
Проводит обследование лабораторий различных форм собственности с целью их возможной дальнейшей отраслевой аттестации.
В пределах компетенции отдела осуществляет проверку соблюдения субъектами хозяйствования требований законодательства о качестве лекарственных средств при их хранении, реализации и медицинском применении.
Обеспечивает контроль за своевременным получением документов от территориальных органов государственной службы об утверждении планов проверок субъектов хозяйствования по контролю качества лекарственных средств.
Работы в соответствии с Законом Украины «Об основных принципах государственного надзора (контроля) в сфере хозяйственной деятельности», с согласованием с территориальными органами Государственной службы по проведению внеплановых проверок качества, субъектов хозяйствования, осуществляющих производство (в аптечных условиях), оптовая, розничная торговля лекарственными средствами и применение лекарственных средств.
Анализирует заключения экспертных учреждений о критичности выявленных несоответствий в отношении лекарственных средств для решения вопроса об их дальнейшем обращении. .
.
В случае установления признаков административного правонарушения при проведении проверок субъектов хозяйствования составляются протоколы и налагаются административные взыскания.
Формирование планов проверок субъектов хозяйствования в соответствии с Законом Украины «Об основах государственного надзора (контроля) в сфере хозяйственной деятельности»
Работы по копиям регистрационных удостоверений лекарственных средств, методов контроля качества (в том числе текста маркировки к регистрационному удостоверению), инструкций по применению лекарственных средств (инструкций по медицинскому применению), предоставленных в установленном порядке Государственным предприятием «Государственное Экспертный центр МОЗ Украины «И/или держателей регистрационных удостоверений, их представителей, в Государственную службу, и осуществляет их размещение в ЕАИС.
Практика обращения субъектов хозяйствования в отношении оригинальной упаковки лекарственных средств и размещения их в ЕАИС (ЄАІС).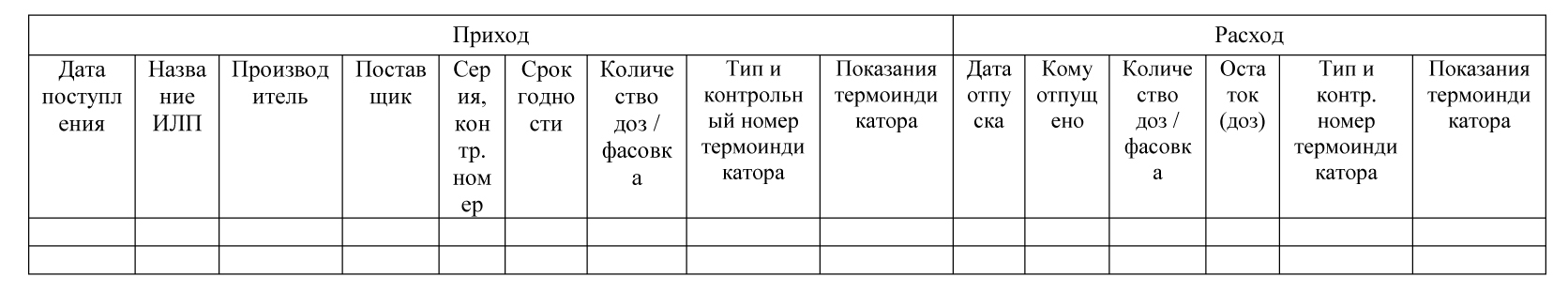
Выполняет иные функции в соответствии с возложенными на Департамент задачами.
Законодательство Украины об указанных упомянутых вопросы:
BA/96-%D0%B2%D1%80?lang=ru
2. Кодекс Украины об административных правонарушениях
https://zakon.rada.gov.ua/laws/show/80731-10?lang=ru
3. Закон Украины «О лекарственных средствах»
https://zakon.rada.gov.ua/laws/show/123/96-%D0%B2%D1%80?lang=ru
4. Закон Украины «О лицензировании различных видов хозяйственной деятельность»
https://zakon.rada.gov.ua/laws/show/222-19?lang=ru
5. Закон Украины «Об основных принципах государственного надзора (надзора) в сфере коммерческой деятельности»
https://zakon.rada.gov.ua/laws/show/877-16?lang=ru
6. Закон Украины «О внесении изменений в некоторые законодательные акты Украины в части усиления ответственности за фальсификацию или Обращение фальсифицированных лекарственных средств»
https://zakon.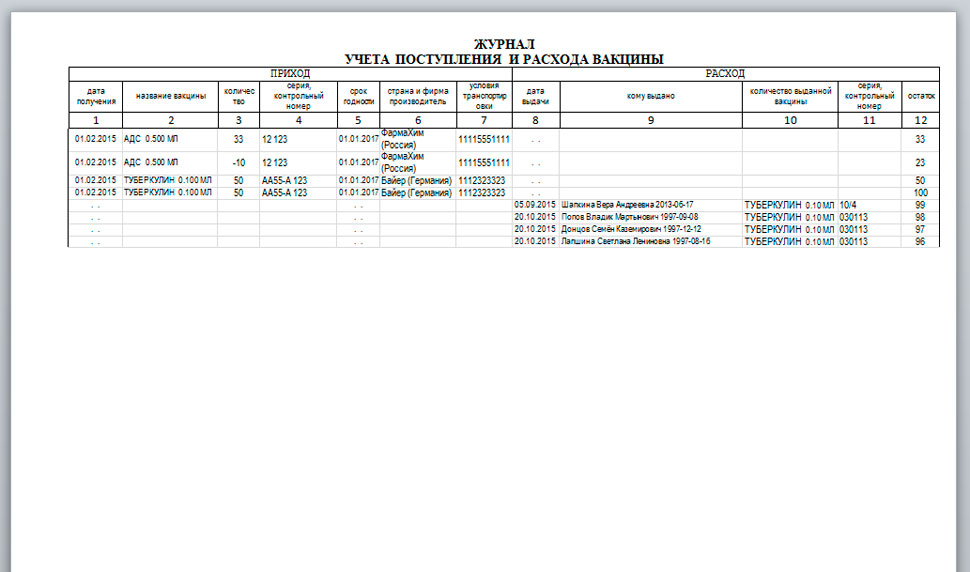 rada.gov.ua/laws/show/5065-17?lang=ru
rada.gov.ua/laws/show/5065-17?lang=ru
7. Закон Украины «Основы законодательства Украины о здравоохранении
https://zakon.rada.gov.ua/laws/show/2801-12?lang=ru
8. Закон Украины «О внесении изменений в некоторые законодательные акты Украины относительно предотвращения фальсификации лекарственных средств»
https://zakon.rada.gov.ua/laws/show/3718-17?lang=en
9. Закон Украины «Об обращениях граждан». 10. Закон Украины «О доступе к публичной информации»
https://zakon.rada.gov.ua/laws/show/2939-17?lang=ru
11. Закон Украины «О ратификации Конвенции Совета Европы о борьбе с контрафактной медицинской продукцией и аналогичными преступлениями, представляющими угрозу для здоровья населения»
https://zakon.rada.gov.ua/laws/show/4908 -17?lang=en
12. Постановление Кабинета Министров Украины от 12.08.2015 № 647 «Об утверждении Положения о Государственной службе Украины по наркотикам и контролю за наркотиками»
https: //zakon. rada.gov.ua/laws/show/647-2015-%D0%BF?lang=ru
rada.gov.ua/laws/show/647-2015-%D0%BF?lang=ru
13. Постановление Кабинета Министров Украины от 6 мая 2000 г. № 770 «Об утверждении Перечня наркотических средств, психотропных веществ и прекурсоров»
https://zakon3.rada.gov.ua /laws/show/770-2000-%D0%BF?lang=en
14. Постановление Кабинета Министров Украины от 28 апреля 2000 г. № 728 «Об утверждении Порядка выезда на Украина или уничтожение некачественных и непригодных к использованию товаров (объектов) гуманитарной помощи» (с изменениями)
https://zakon3.rada.gov.ua/laws/show/728-2000-%D0%BF?lang=en
15. Постановление Кабинета Министров Украины от 14 сентября 2005 г. № 902 «Об утверждении Порядка проведения государственного контроля качества лекарственных средств, ввозимых в Украину»
https://zakon.rada.gov.ua/laws/show/902-2005-%D0%BF?lang=ru
16. Постановление Кабинета Министров Украины от 31.10.2007 № 1279 «Об утверждении Порядка возмещения субъектом расходов, связанных с проведением экспертизы (испытаний) образцов продукции» (с изменениями )
https://zakon3. rada.gov.ua/laws/show/1279-2007-%D0%BF?lang=ru
rada.gov.ua/laws/show/1279-2007-%D0%BF?lang=ru
17. Постановление Кабинета Министров Украины от 31 октября 2007 г., № 1280 «Об утверждении Порядка отбора проб для определения показателей ее качества и формы выборочного образца продукции»
https://zakon3.rada.gov.ua/laws/show/1280-2007-% D0%BF?lang=en
18. Постановление Кабинета Министров Украины от 26 мая 2005 г. № 376 «Об утверждении Порядка государственной регистрации (перерегистрации) лекарственных средств и размеров сборов об их государственной регистрации (перерегистрации)» (с изменениями)
https://zakon.rada.gov.ua/laws/show/376-2005-%D0%BF?lang=en
19. Постановление Кабинета Министров Украины от 3 февраля 2010 г. № 260 «Некоторые вопросы государственного контроля качества лекарственных средств» (с изменениями)
https://zakon3.rada.gov.ua/laws/show/260-2010-%D0%BF?lang=ru
20. Постановление Кабинета Министров Украины от 08.12.2010 № 1114 «Об утверждении Соглашения о сотрудничестве в борьбе с оборотом фальсифицированных лекарственных средств»
https://zakon. rada.gov.ua/laws/show/1114-2010-%D0%BF?lang=en
rada.gov.ua/laws/show/1114-2010-%D0%BF?lang=en
21. Постановление Кабинета Министров Украины от 15 января 1996 г. № 73 «Об утверждении Положения о контроле за соответствием иммунобиологических препаратов, применяемых в медицинской практике, требованиям государственных и международных стандартов»
https://zakon3.rada.gov.ua/laws/show/73- 96-%D0%BF?lang=ru
22. Приказ Министерства здравоохранения Украины от 17.10.2012 № 812 «Об утверждении Правил производства (изготовления) и контроля качества лекарственных средств в аптеках (с изменениями), зарегистрированный Министерством юстиции Украины от 2 ноября 2012 г. № 1846/22158,
https://zakon3.rada.gov.ua/laws/show/z1846-12?lang=en
23. Приказ МОЗ Украины от 29 сентября 2014 г. № 677 «Об утверждении Порядка контроля качества лекарственных средств при оптовой и розничной торговле», зарегистрированный Министерством юстиции Украины от 26 ноября 2014 г. № 1515/26292
https://zakon3. rada.gov.ua/laws/ show/z1515-14?lang=en
rada.gov.ua/laws/ show/z1515-14?lang=en
24. Приказ МЗ Украины от 22 ноября 2011 г. № 809«Об утверждении Порядка запрещения (прекращения) и возобновления обращения лекарственных средств на рынке на территории Украины», зарегистрированного Министерством юстиции Украины от 30 января 2912 г. № 126/20439
https:// zakon3.rada.gov.ua/laws/show/z0126-12?lang=en
25. Приказ Министерства здравоохранения Украины от 17 июня 2005 г. № 287 «Об утверждении Порядка взаимодействия между Государственной инспекцией по контролю качества лекарственных средств МЗ Украины и Государственным фармакологическим центром МЗ Украины в сфере лекарственных средств»
26. Приказ Министерства здравоохранения Украины от 16.12.2003 г. № 584″ «Об утверждении Правил хранения и контроля качества лекарственных средств в учреждениях здравоохранения», зарегистрированных Министерством юстиции Украины от 03 марта 2004 г. № 275/8874
https://zakon.rada.gov.ua/laws/show/z0275-04?lang=en
27. Приказ Минздрава Украины от 14 января 2004 г. № 10 «Об утверждении Порядка проведения отраслевой аттестации лабораторий контроля качества и безопасности лекарственных средств» (с изменениями), зарегистрированного Министерством юстиции Украины 30 января 2004 г. № 130/8729
Приказ Минздрава Украины от 14 января 2004 г. № 10 «Об утверждении Порядка проведения отраслевой аттестации лабораторий контроля качества и безопасности лекарственных средств» (с изменениями), зарегистрированного Министерством юстиции Украины 30 января 2004 г. № 130/8729
https://zakon.rada.gov.ua/laws/show/z0130-04?lang=ru
28. Приказ МЗ Украины от 15 января 2003 г. № 8 «Об утверждении перечней вспомогательных веществ и красителей, разрешенных к применению при производстве лекарственных средств, которые (лекарства) зарегистрированы в Украине и изготавливаются в аптечных условиях по рецептам врачей и предписаниям лечебно-профилактических учреждений» (с изменениями), зарегистрированными Министерство юстиции Украины 29 января, 2003 г. № 69/7390
https://zakon.rada.gov.ua/laws/show/z0069-03?lang=ru
29. Приказ Министерства здравоохранения Украины от 26 октября 2003 г. 2001 № 428 «Об утверждении Инструкции по регистрации административных правонарушений законодательства Украины в части обеспечения качества лекарственных средств», зарегистрирована Министерством юстиции Украины 18 января 2002 г.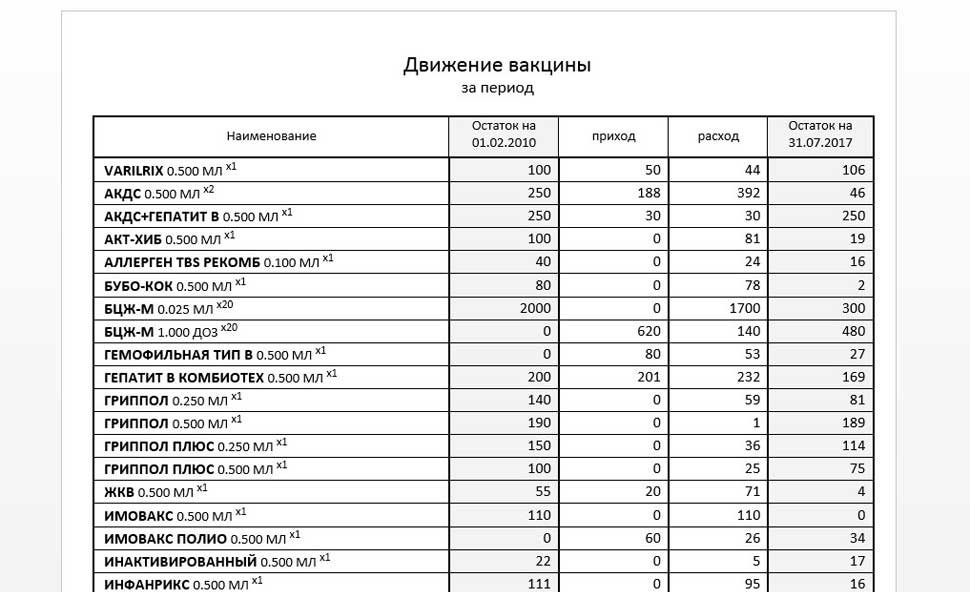 № 47/6335
№ 47/6335
https: //zakon.rada.gov.ua/laws/show/z0047-02?lang=en
30. Приказ Министерства здравоохранения Украины от 25.08.2010 г. № 722 «Об утверждении Порядка маркировки лекарственных средств шрифтом Брайля», зарегистрированный Министерством юстиции Украины 5 ноября 2010 г. № 1044 /18339
https://zakon.rada.gov.ua/laws/show/z1044-10?lang=en
31. Приказ МОЗ Украины от 24 апреля 2015 г. № 242 «Об утверждении Правил использования и уничтожения лекарственных средств», зарегистрированных Министерством юстиции Украины 18 мая 2015 г. № 550/26995
https://zakon.rada.gov.ua/laws/show/z0550-15?lang=en
32. Приказ Министерства здравоохранения Украины от 26 апреля 2011 г. № 237 « Об утверждении Порядка ввоза на территорию Украины незарегистрированных лекарственных средств, стандартных образцов, реактивов» (с изменениями), зарегистрированный Министерством юстиции Украины 11 августа 2011 г. № 965/19703
https: //zakon. rada.gov.ua/laws/show/z0965-11?lang=en
rada.gov.ua/laws/show/z0965-11?lang=en
33. Приказ Министерства здравоохранения Украины от 06 июня 2012 г. № 422 «О некоторых вопросах Запрет рекламы лекарственных средств», зарегистрирована Министерством юстиции Украины 16.07.2012 г. № 1189./21501
https://zakon.rada.gov.ua/laws/show/z1189-12?lang=en
34. Приказ Министерства здравоохранения Украины от 27 декабря 2006 г. № 898 «Об утверждении Порядка осуществления фармаконадзора» (с изменениями), зарегистрированного Министерством юстиции Украины 29 января 2007 г. № 73/13340
https://zakon.rada.gov.ua/laws/show/ z0073-07?lang=ru
35. Приказ Министерства здравоохранения Украины от 01.10.2014 № 698 «Об утверждении Порядка контроля соответствия иммунобиологических препаратов, применяемых в медицинской практике, Требования национальных и международных стандартов», зарегистрированного Министерством юстиции Украины 29 октября., 2014 г. № 1356/26133
https://zakon. rada.gov.ua/laws/show/z1356-14?lang=ru
rada.gov.ua/laws/show/z1356-14?lang=ru
36. Приказ Министерства здравоохранения Украины от 21 января 2014 г. 2013 г., № 39 «Об утверждении форм документов, применимых к государственному контролю качества лекарственных средств, ввозимых в Украину», зарегистрирована Министерством юстиции Украины 08 февраля 2013 г. под № 234/22766
https ://zakon.rada.gov.ua/laws/show/z0234-13?lang=en
37. Приказ Министерства здравоохранения Украины от 8 декабря 2015 г. № 830 «Об утверждении и введении в действие Государственной фармакопеи Украины (II издание)»
38. Приказ МОЗ Украины от 05 декабря 2016 г. № 1308 «Об утверждении и введении в действие Дополнения № 1 к Государственной Фармакопее Украины (II издание)»
39. Приказ МОЗ Украины от 14 марта 2018 г. № 476 «Об утверждении и введении в действие дополнения № 2 к Государственной фармакопее Украины (II издание)»
40. Приказ МЗ Украины от 20 июня 2018 г.