Приказ Росздравнадзора от 10.07.2020 N 5974 «Об утверждении Административного регламента Федеральной службы по надзору в сфере здравоохранения по осуществлению государственного контроля качества и безопасности медицинской деятельности» (Зарегистрировано в Минюсте России 07.08.2020 N 59208)
- Главная
- Документы
- Приказ
- Административный регламент Федеральной службы по надзору в сфере здравоохранения по осуществлению государственного контроля качества и безопасности медицинской деятельности
- I. Общие положения
- Наименование функции
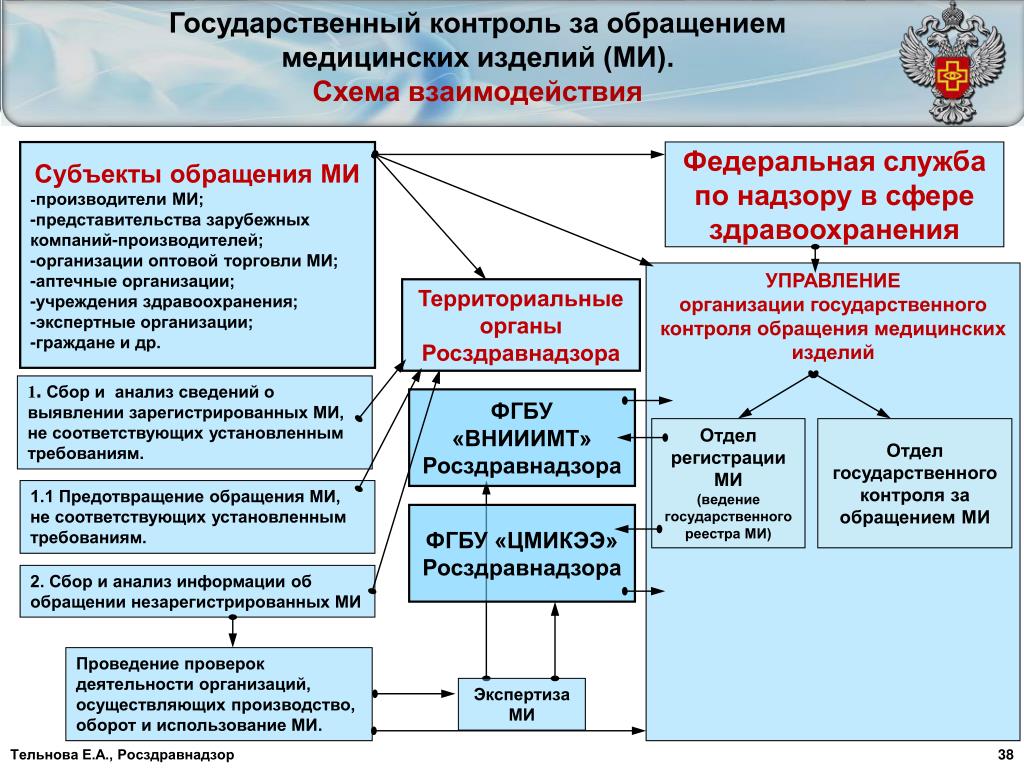
- Наименование органа, осуществляющего государственный контроль (надзор)
- Нормативные правовые акты, регулирующие осуществление государственного контроля (надзора)
- Предмет государственного контроля (надзора)
- Права и обязанности должностных лиц при осуществлении государственного контроля (надзора)
- Права и обязанности лиц, в отношении которых осуществляются мероприятия по государственному контролю (надзору)
- Описание результата осуществления государственного контроля (надзора)
- Исчерпывающий перечень документов и (или) информации, необходимых для осуществления государственного контроля (надзора) и достижения целей и задач проведения проверки
- II.
 Требования к порядку осуществления государственного контроля (надзора). Порядок информирования об исполнении функции
Требования к порядку осуществления государственного контроля (надзора). Порядок информирования об исполнении функции - Срок осуществления государственного контроля (надзора)
- III. Состав, последовательность и сроки выполнения административных процедур (действий), требования к порядку их выполнения, в том числе особенности выполнения административных процедур (действий) в электронной форме
- Исчерпывающий перечень административных процедур
- Планирование проведения проверок
- Принятие решения о проведении проверки
- Проведение проверки
- Оформление результатов проверки
- Принятие мер по результатам проверки
- Проведение контрольной закупки
- IV. Порядок и формы контроля за осуществлением государственного контроля (надзора)
- Порядок осуществления текущего контроля за соблюдением и исполнением должностными лицами Росздравнадзора (территориальных органов) положений регламента и иных нормативных правовых актов, устанавливающих требования к осуществлению государственного контроля (надзора), а также принятием ими решений
- Порядок и периодичность осуществления плановых и внеплановых проверок полноты и качества осуществления государственного контроля (надзора), в том числе порядок и формы контроля за полнотой и качеством осуществления государственного контроля (надзора)
- Ответственность должностных лиц Росздравнадзора (территориальных органов) за решения и действия (бездействие), принимаемые (осуществляемые) ими в ходе осуществления государственного контроля (надзора)
- Положения, характеризующие требования к порядку и формам контроля за исполнением государственной функции, в том числе со стороны граждан, их объединений и организаций
- V.
 Досудебный (внесудебный) порядок обжалования решений и действий (бездействия) Росздравнадзора (территориального органа), а также его должностных лиц
Досудебный (внесудебный) порядок обжалования решений и действий (бездействия) Росздравнадзора (территориального органа), а также его должностных лиц - Информация для заинтересованных лиц об их праве на досудебное (внесудебное) обжалование действий (бездействия) и (или) решений, принятых (осуществленных) в ходе осуществления государственного контроля (надзора)
- Предмет досудебного (внесудебного) обжалования
- Исчерпывающий перечень оснований для приостановления рассмотрения жалобы и случаев, в которых ответ на жалобу не дается
- Основания для начала процедуры досудебного (внесудебного) обжалования
- Права заинтересованных лиц на получение информации и документов, необходимых для обоснования и рассмотрения жалобы
- Органы государственной власти, организации и уполномоченные на рассмотрение жалобы лица, которым может быть направлена жалоба заявителя в досудебном (внесудебном) порядке
- Сроки рассмотрения жалобы
- Результат досудебного (внесудебного) обжалования применительно к каждой процедуре либо инстанции обжалования
Приказ
Прокурор разъясняет — Прокуратура Республики Крым
Прокурор разъясняет
- 21 октября 2020, 12:25
Утверждён Административный регламент Росздравнадзора по осуществлению федерального государственного надзора в сфере обращения лекарственных средств
Текст
Поделиться
17 октября вступит в силу приказ Федеральной службы по надзору в сфере здравоохранения от 28. 07.2020 № 6720 «Об утверждении Административного регламента Федеральной службы по надзору в сфере здравоохранения по осуществлению федерального государственного надзора в сфере обращения лекарственных средств».
07.2020 № 6720 «Об утверждении Административного регламента Федеральной службы по надзору в сфере здравоохранения по осуществлению федерального государственного надзора в сфере обращения лекарственных средств».
Государственной функцией, регулируемой утвержденным Административным регламентом, является осуществление федерального государственного надзора в сфере обращения лекарственных средств.
Предметом государственного контроля (надзора) является:
- организация и проведение проверок соблюдения субъектами обращения лекарственных средств требований к доклиническим исследованиям лекарственных средств, клиническим исследованиям лекарственных препаратов, хранению, перевозке, отпуску, реализации лекарственных средств, применению лекарственных препаратов, уничтожению лекарственных средств;
- проверка соответствия лекарственных средств, находящихся в гражданском обороте, требованиям фармакопейной статьи либо в случае ее отсутствия нормативной документации;
- проверка соблюдения аптечными организациями требований к розничной торговле лекарственными препаратами для медицинского применения дистанционным способом.

Государственный надзор осуществляется Росздравнадзором и его территориальными органами.
Административный регламент закрепляет основания проведения проверок, сроки и последовательность процедур при проведении надзорных мероприятий, права и обязанности должностных лиц Росздравнадзора (территориальных органов) при осуществлении государственного надзора, а также проверяемых лиц, порядок досудебного обжалования действий (бездействий) и решений, осуществленных (принятых) должностными лицами Росздравнадзора (территориальных органов) при осуществлении государственного надзора.
Полный текст Административного регламента опубликован на «Официальном интернет-портале правовой информации» (www.pravo.gov.ru) 06.10.2020.
Утверждён Административный регламент Росздравнадзора по осуществлению федерального государственного надзора в сфере обращения лекарственных средств
17 октября вступит в силу приказ Федеральной службы по надзору в сфере здравоохранения от 28. 07.2020 № 6720 «Об утверждении Административного регламента Федеральной службы по надзору в сфере здравоохранения по осуществлению федерального государственного надзора в сфере обращения лекарственных средств».
07.2020 № 6720 «Об утверждении Административного регламента Федеральной службы по надзору в сфере здравоохранения по осуществлению федерального государственного надзора в сфере обращения лекарственных средств».
Государственной функцией, регулируемой утвержденным Административным регламентом, является осуществление федерального государственного надзора в сфере обращения лекарственных средств.
Предметом государственного контроля (надзора) является:
- организация и проведение проверок соблюдения субъектами обращения лекарственных средств требований к доклиническим исследованиям лекарственных средств, клиническим исследованиям лекарственных препаратов, хранению, перевозке, отпуску, реализации лекарственных средств, применению лекарственных препаратов, уничтожению лекарственных средств;
- проверка соответствия лекарственных средств, находящихся в гражданском обороте, требованиям фармакопейной статьи либо в случае ее отсутствия нормативной документации;
- проверка соблюдения аптечными организациями требований к розничной торговле лекарственными препаратами для медицинского применения дистанционным способом.

Государственный надзор осуществляется Росздравнадзором и его территориальными органами.
Административный регламент закрепляет основания проведения проверок, сроки и последовательность процедур при проведении надзорных мероприятий, права и обязанности должностных лиц Росздравнадзора (территориальных органов) при осуществлении государственного надзора, а также проверяемых лиц, порядок досудебного обжалования действий (бездействий) и решений, осуществленных (принятых) должностными лицами Росздравнадзора (территориальных органов) при осуществлении государственного надзора.
Полный текст Административного регламента опубликован на «Официальном интернет-портале правовой информации» (www.pravo.gov.ru) 06.10.2020.
Проверка СМК производителей медицинских изделий
Опубликовано от bewire
Заводской аудит при регистрации и внесение изменений стали реальностью не только в регламенте ЕАЭС, но и в национальной системе регистрации медицинских изделий. Наше сравнение ниже:
| № | Товар | Национальная система | ЕАЭС |
| 1 | Основной документ | Постановление Правительства Российской Федерации от 09.02.2022 № 135 «Об утверждении Правил организации и проведения проверок производства медицинских изделий на соответствие требованиям по внедрению, поддержанию и оценке системы менеджмента качества для медицинских изделий, в зависимости от потенциального риска их использования»
Примечание: В общем виде под проверкой в соответствии с Постановлением понимается процедура внесения изменений в документы, содержащиеся в регистрационном досье (если такая процедура требует проверки качества, безопасности и эффективности или вносит изменения в сведения о производственных площадках), как а также к проверке СМК производственных предприятий, изготавливающих медицинские изделия по индивидуальному заказу | Постановление Совета Евразийской экономической комиссии от 10. 11.2017 № 106 «О Требованиях к внедрению, поддержанию и оценке системы менеджмента качества медицинских изделий в зависимости от потенциального риска их применения» (с изменениями Решением Совета ЕЭК от 12.11.2021 № 131 «О внесении изменений в Требования к внедрению, поддержанию и оценке системы менеджмента качества медицинских изделий в зависимости от потенциального риска их применения») 11.2017 № 106 «О Требованиях к внедрению, поддержанию и оценке системы менеджмента качества медицинских изделий в зависимости от потенциального риска их применения» (с изменениями Решением Совета ЕЭК от 12.11.2021 № 131 «О внесении изменений в Требования к внедрению, поддержанию и оценке системы менеджмента качества медицинских изделий в зависимости от потенциального риска их применения») |
| 2 | Частичное/полное действие требований инспекции | Частичное действие с 01.01.2022 (без проведения проверки в текущий момент, но с внеплановой проверкой в течение 2 лет), полное действие с 01.06.2023 (с проверкой).
Примечание: если изменения в документы, содержащиеся в регистрационном досье, не были внесены до 01.06.2023 (не «подтверждены» Росздравнадзором), из текста Приказа следует, что проверка будет требуется сейчас, а не в течение 2 лет | Полное действие с 15.03.2019 |
| 3 | Обязательный осмотр | Стерильный класс IIa, класс IIb и класс III Примечание: здесь и далее независимо от того, относится ли это к диагностике in vitro или нет | Стерильный класс IIa, класс IIb и класс III Примечание: здесь и далее независимо от того, относится ли это к диагностике in vitro или нет |
| 4 | Добровольная инспекция | Класс I или Класс IIa нестерильный | Класс I или Класс IIa нестерильный |
| 5 | Применение результатов контроля к группам/подгруппам медицинских изделий | Приложение; группы для класса I и класса IIa (стерильные и нестерильные), подгруппы для класса IIb и класса III; перечень групп/подгрупп эквивалентен национальной системе и системе ЕАЭС | Приложение; группы для класса I и класса IIa (стерильные и нестерильные), подгруппы для класса IIb и класса III; перечень групп/подгрупп эквивалентен национальной системе и системе ЕАЭС |
| 6 | Частота плановых проверок | Не реже одного раза в 5 лет | Не реже одного раза в 3 года |
| 7 | Время первоначальной проверки | Точно не указано, за исключением изменений сведений о производственных площадках; в этом случае до подачи заявления о внесении изменений в Федеральную службу по надзору в сфере здравоохранения (Росздравнадзор) | При проведении проверки после начала регистрации |
| 8 | Общая продолжительность | Общий срок проведения производственного контроля не должен превышать 90 рабочих дней с даты подачи заявления о проведении производственного контроля | Срок организации и проведения производственного контроля не должен превышать в сумме 90 рабочих дней со дня принятия решения о начале производственного контроля |
помечено FAQ
Росздравнадзор продлевает полномочия инспекции
/в Публикации /по МаркетингуМинздравом России разработаны изменения в Положение о Федеральной службе по надзору в сфере здравоохранения. Проект подготовлен в целях реализации Соглашения о единых принципах и правилах обращения медицинских изделий и лекарственных средств в Евразийском экономическом союзе (ЕАЭС). Проект предусматривает формирование общих рынков изделий медицинского назначения и лекарственных средств в рамках Евразийского экономического союза и принятие мер, необходимых для гармонизации и унификации законодательства государств-членов Союза в сфере обращения изделий медицинского назначения и лекарственных средств. Проект документа доступен по ссылке: https://regulation.gov.ru/projects#npa=106260.
Перечень предлагаемых изменений:
– Проведение проверок испытательных лабораторий и аудитов доклинических (неклинических) исследований лекарственных средств на соответствие Правилам надлежащей лабораторной практики (НЛП) ЕАЭС.
Благодаря этому изменению уполномоченные органы будут проверять процедуры и практику лаборатории для оценки соответствия принципам GLP.
Также появился аналогичный пункт для инспектирования клинических исследований по правилам Надлежащей клинической практики (GCP).
– Осуществление проверки организаций, проводящих клинические исследования лекарственных средств, на соответствие требованиям GCP.
В рамках данной проверки уполномоченные органы проверяют документы, инфраструктуру, записи, договоры об обеспечении качества и любые другие источники, которые рассматриваются уполномоченным органом как имеющие отношение к исследованию и которые могут находиться в исследовательском центре, объектах спонсора и/или подрядной исследовательской организации или в иных организациях, которые, по мнению уполномоченного органа, требуют проверки.
Следующий пункт поправок касается соблюдения правил надлежащей дистрибьюторской практики (GDP).
– Проверка соблюдения субъектами обращения лекарственных средств для медицинского применения надлежащих условий хранения, перевозки и отпуска лекарственных средств согласно ВВП.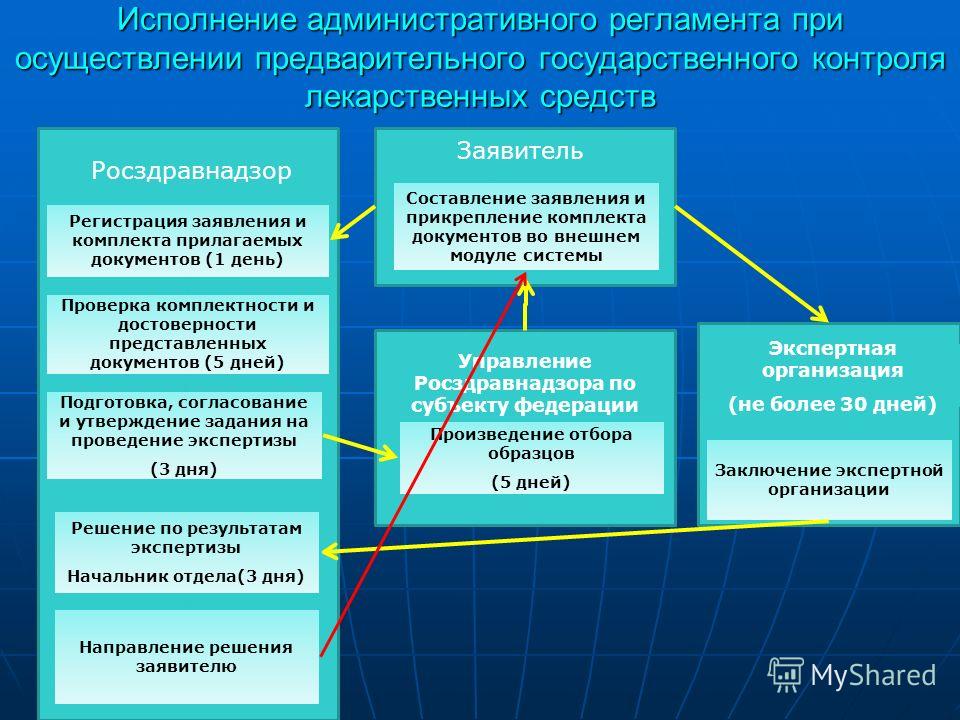

 Требования к порядку осуществления государственного контроля (надзора). Порядок информирования об исполнении функции
Требования к порядку осуществления государственного контроля (надзора). Порядок информирования об исполнении функции Досудебный (внесудебный) порядок обжалования решений и действий (бездействия) Росздравнадзора (территориального органа), а также его должностных лиц
Досудебный (внесудебный) порядок обжалования решений и действий (бездействия) Росздравнадзора (территориального органа), а также его должностных лиц