План проверок на 2020 год
ПЛАН ПРОВЕРОК
Государственный контроль в виде плановых проверок зачастую становится тяжелым испытанием для лиц, ведущих коммерческую деятельность. Неудивительно, что федеральный закон, вносящий коррективы в правила проведения плановых проверок, будет с интересом воспринят теми, кто имеет непосредственное отношение к бизнесу.
Сводный план проведения плановых проверок Государственной инспекции труда по городу Санкт-Петербург на 2020 год:
Государственная инспекция
труда г. Санкт-Петербурге
План проведения плановых проверок Государственной инспекции труда в Ленинградской области юридических лиц и индивидуальных предпринимателей на 2020 год:
Государственная инспекция
труда в Ленинградской области
Кроме того, не следует забывать, что всегда может быть проведена внеплановая проверка по обращению заинтересованного лица, при которой контролирующие органы более тщательно проверяют предприятие
Федеральный закон от 13. 07.2015 N 246-ФЗ «О внесении изменений в Федеральный закон «О защите прав юридических лиц и индивидуальных предпринимателей при осуществлении государственного контроля (надзора) и муниципального контроля» принят Федеральным собранием и одобрен Президентом РФ.
07.2015 N 246-ФЗ «О внесении изменений в Федеральный закон «О защите прав юридических лиц и индивидуальных предпринимателей при осуществлении государственного контроля (надзора) и муниципального контроля» принят Федеральным собранием и одобрен Президентом РФ.
Обозначим самые важные изменения:
Отменены плановые проверки малых предпринимателей на три календарных года: в период с начала 2016 года до конца 2018 года. Здесь можно воскликнуть «Ура!», однако следует знать, что есть исключения из этого правила:
— если лицо ранее допускало грубые нарушения КоАП РФ, что было выявлено в ходе предыдущей проверки, и данное лицо было привлечено за такие действия к административной ответственности, либо за иные нарушения лицо было дисквалифицировано или деятельность административно приостановлена (или приостановлена/аннулирована лицензия), и с момента завершения проверки не прошло трех лет- такое лицо снова может быть проверено.

- Если субъект малого предпринимательства нашел себя в перечне лиц для плановой проверки, в обход моратория – он вправе потребовать от надзорного органа исключить его из ежегодного плана проверок.
- Проверяющим должностным лицам теперь необходимо разъяснять каждому контролируемому лицу содержание указанных выше положений. При предоставлении подтверждающих документов о том, что юридическое лицо (предприниматель) считается субъектом малого бизнеса, проверка прекращается.
- Отмена проверок не касается некоторых «стратегически» важных сфер: промышленной безопасности и пожарного надзора, а также безопасности гидротехнических сооружений в отношении субъектов, эксплуатирующих опасные производственные объекты и гидротехнические сооружения 1 или 2 класса опасности; экологического надзора – по объектам, отрицательно влияющим на окружающую среду 1 или 2 категории; радиационной безопасности и использования атомной энергии; в сфере охраны государственной тайны; лицензионного контроля в отношении организаций, управляющих многоквартирными домами; внешнего контроля за аудиторскими организациями.

- Проведение плановой проверки с нарушениями новых правил считается грубым нарушением требований законодательства, итоги проверки будут являться недействительными.
- В ФЗ № 294-ФЗ внесено и раскрыто понятие «риск-ориентированного подхода» при организации проверок, внедряемого в целях снижения издержек при проведении проверок – как для проверяющих органов, так и для контролируемых субъектов. Данный подход заключается в отнесении деятельности подконтрольных субъектов к установленным классам опасности (оценка тяжести вероятных негативных последствий нарушения) или категориям риска (оценивается вероятность несоблюдения требований). Правила и критерии распределения устанавливает Правительство РФ. Нормы о риск-ориентированном подходе применяются с 1 января 2018 года.
 Стоит внимательно изучить новшества – чтобы применить в случае, если с проверкой все же нагрянут. Кроме того, не следует забывать, что всегда может быть проведена внеплановая проверка – по обращению заинтересованного лица и тогда сослаться на установленный мораторий не получится.
Стоит внимательно изучить новшества – чтобы применить в случае, если с проверкой все же нагрянут. Кроме того, не следует забывать, что всегда может быть проведена внеплановая проверка – по обращению заинтересованного лица и тогда сослаться на установленный мораторий не получится.
Естественно, что решить попадает под действие данного моратория ваша конкретная проверка крайне непросто порой. Либо определиться, что происходит с проверками экологического надзора или проверками трудовой инспекции. Либо понять что делать, если несмотря на мораторий к вам приходит проверка. Именно поэтому наиболее полно защиту прав и интересов готовы предоставить специалисты нашей компании.
Планы и результаты проведения плановых проверок — Профилактическая работа и контрольно-надзорная деятельность
Изменения правил проведения проверок. Ответы на часто задаваемые вопросы:
Осуществляется ли в настоящее время снижение нагрузки со стороны контролирующих органов МЧС России на субъекты предпринимательства?
В целях создания благоприятной среды для малого бизнеса статьей 26.
Кроме того, в соответствии с приказом МЧС России от 12. 09.2016 № 492 «О запрещении проверок малого и среднего предпринимательства» проведение внеплановых выездных проверок по контролю исполнения ранее выданных предписаний в отношении субъектов малого и среднего предпринимательства допускается при наличии в материалах проверки сведений об угрозе жизни и здоровью людям.
09.2016 № 492 «О запрещении проверок малого и среднего предпринимательства» проведение внеплановых выездных проверок по контролю исполнения ранее выданных предписаний в отношении субъектов малого и среднего предпринимательства допускается при наличии в материалах проверки сведений об угрозе жизни и здоровью людям.
Под угрозой жизни и здоровью людям следует понимать выявленные при проверке нарушения требований пожарной безопасности, связанные с обеспечением возможности своевременного обнаружения пожара, оповещения о нем всех людей, находящихся на объекте защиты, их эвакуации до достижения критических значений опасных факторов пожара, неготовностью персонала обеспечить своевременную эвакуацию людей из здания, а также нарушений, которые напрямую могут привести к возникновению пожара.
Одновременно, на основании статьи 5 Федерального закона от 22 июля 2008 года № 123-ФЗ «Технический регламент о требованиях пожарной безопасности» каждый объект защиты должен иметь систему обеспечения пожарной безопасности, которая включает в себя систему предотвращения пожара, систему противопожарной защиты, комплекс организационно-технических мероприятий по обеспечению пожарной безопасности.
Если на объекте защиты отсутствует комплекс мероприятий, обеспечивающих защиту людей при пожаре, следовательно, существует угроза жизни и здоровью людей. Под комплексом мероприятий подразумевается оснащение объекта защиты системами автоматического пожаротушения и пожарной сигнализацией, системой оповещения и управления эвакуацией людей при пожаре, устройство эвакуационных путей и выходов. Для каждого конкретного случая необходимость применения той или иной системы противопожарной защиты регламентируется федеральными законами и иными нормативными правовыми актами Российской Федерации, устанавливающими обязательные для исполнения требования пожарной безопасности.
В соответствии с п. 10 статьи 12.2 Федерального конституционного закона от 21 марта 2014 г. № 6-ФКЗ «О принятии в Российскую Федерацию Республики Крым и образовании в составе Российской Федерации новых субъектов — Республики Крым и города федерального значения Севастополя» плановые проверки юридических лиц и индивидуальных предпринимателей на территориях Республики Крым и города федерального значения Севастополя до 1 января 2018 года не проводятся.
Как учитываются при планировании проверок проведенная в отношении объекта защиты оценка соответствия объекта защиты требованиям пожарной безопасности (НОР).
В соответствии с положениями постановления Правительства Российской Федерации от 17.08.2016
№ 806 «О применении риск-ориентированного подхода при организации отдельных видов государственного контроля (надзора) и внесении изменений в некоторые акты Правительства Российской Федерации» планирование проверок органами ФГПН осуществляется в зависимости от присвоенной объекту защиты категории риска и соответствующей данной категории риску периодичностью.
Выполнение (невыполнение) условий соответствия объекта защиты требованиям пожарной безопасности, подтвержденные путем независимой оценки пожарного риска учитываются надзорными органами как динамический показатель отнесения объекта защиты к определённой категории риска, позволяющий перейти в категорию более низкой опасности.
Таким образом, в случае поступления в орган ФГПН заключения о независимой оценке пожарного риска до утверждения ежегодного плана плановых проверок, объекту защиты присваивается более низкая категории риска, в соответствии с которой объект защиты планируется к проведению плановой проверки, с момента окончания последней плановой проверки, ввода объекта защиты в эксплуатацию или изменения класса его функциональной пожарной опасности.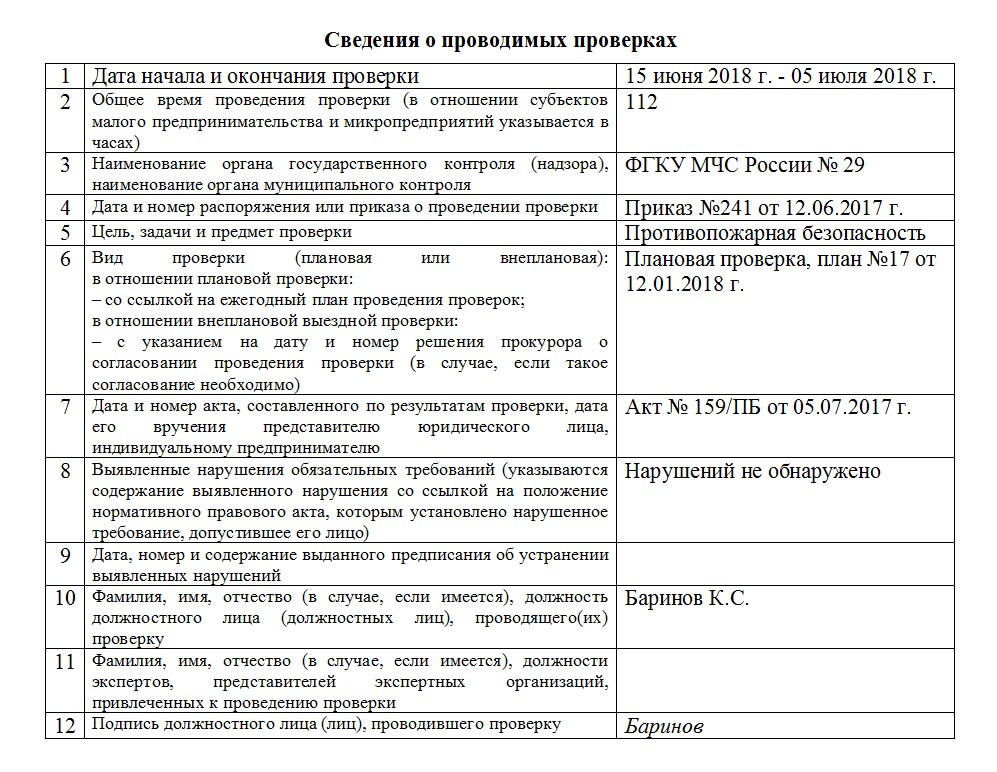
Может ли анонимное обращение являться основанием проведения внеплановой проверки?
В соответствии с Федеральным законом от 02.05.2006 № 59-ФЗ «О порядке рассмотрения обращений граждан Российской Федерации» под обращением гражданина понимается, предложения, заявления или жалобы, поданные в государственный орган или его должностному лицу в письменной форме или в форме электронного документа, а также устно.
Федеральным законом № 59-ФЗ установлены требования к форме и содержанию письменных и устных обращений граждан. Под устным обращением гражданина понимается заявление, принятое на личном приеме, при котором гражданин предъявляет документ, удостоверяющий его личность. Содержание устного обращения заносится в карточку личного приема гражданина.
Гражданин в своем письменном обращении в обязательном порядке указывает наименование государственного органа, в который направляет письменное обращение, либо фамилию, имя, отчество соответствующего должностного лица, либо должность соответствующего лица, а также свои фамилию, имя, отчество (последнее — при наличии), почтовый адрес, по которому должен быть направлен ответ, излагается суть предложения, заявления или жалобы, ставится личная подпись и дата.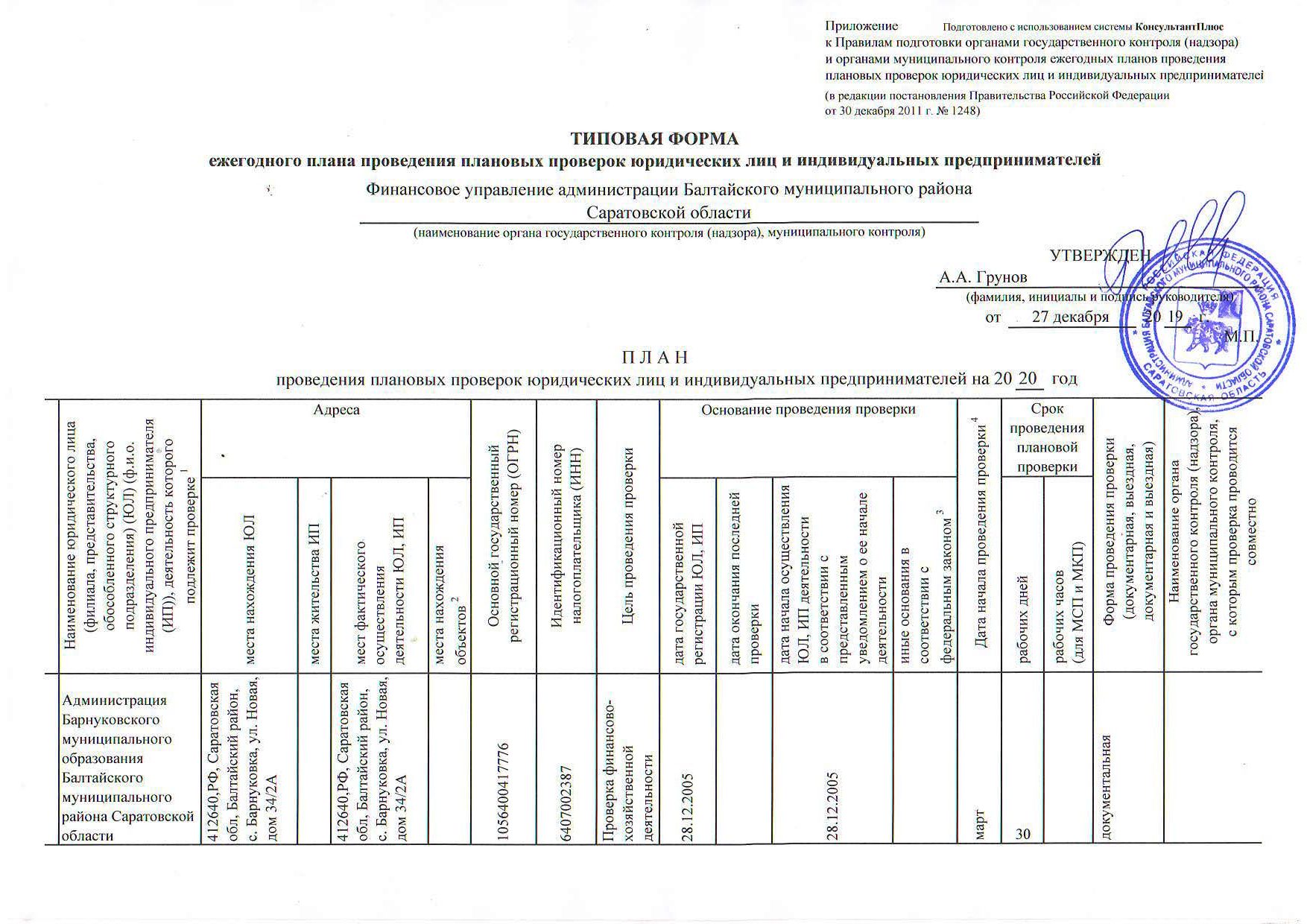 В случае необходимости в подтверждение своих доводов к письменному обращению прилагаются документы и материалы либо их копии.
В случае необходимости в подтверждение своих доводов к письменному обращению прилагаются документы и материалы либо их копии.
В соответствии с частью 3 статьи 10 Федерального Закона от 26.12.2008 № 294-ФЗ «О защите прав юридических лиц и индивидуальных предпринимателей при осуществлении государственного контроля (надзора) и муниципального контроля», обращения и заявления, не позволяющие установить лицо, обратившееся в орган государственного контроля (надзора) не могут служить основанием для проведения внеплановой проверки.
Могут ли служить основанием для проведения внеплановой проверки обращения и заявления, направленные заявителем в форме электронных документов?
Обращения и заявления, направленные заявителем в форме электронных документов, могут служить основанием для проведения внеплановой проверки только при условии, что они были направлены с использованием средств информационно-коммуникационных технологий, предусматривающих обязательную авторизацию заявителя в единой системе идентификации и аутентификации в соответствии с пунктом 2 части 2 статьи 10 Федерального закона от 26. 12.2008 № 294-ФЗ «О защите прав юридических лиц и индивидуальных предпринимателей при осуществлении государственного контроля (надзора) и муниципального контроля».
12.2008 № 294-ФЗ «О защите прав юридических лиц и индивидуальных предпринимателей при осуществлении государственного контроля (надзора) и муниципального контроля».
Новшества при проведении плановых проверок работодателей.
Выбрать журналАктуальные вопросы бухгалтерского учета и налогообложенияАктуальные вопросы бухгалтерского учета и налогообложения: учет в сельском хозяйствеБухгалтер Крыма: учет в унитарных предприятияхБухгалтер Крыма: учет в сельском хозяйствеБухгалтер КрымаАптека: бухгалтерский учет и налогообложениеЖилищно-коммунальное хозяйство: бухгалтерский учет и налогообложениеНалог на прибыльНДС: проблемы и решенияОплата труда: бухгалтерский учет и налогообложениеСтроительство: акты и комментарии для бухгалтераСтроительство: бухгалтерский учет и налогообложениеТуристические и гостиничные услуги: бухгалтерский учет и налогообложениеУпрощенная система налогообложения: бухгалтерский учет и налогообложениеУслуги связи: бухгалтерский учет и налогообложениеОплата труда в государственном (муниципальном) учреждении: бухгалтерский учет и налогообложениеАвтономные учреждения: акты и комментарии для бухгалтераАвтономные учреждения: бухгалтерский учет и налогообложениеБюджетные организации: акты и комментарии для бухгалтераБюджетные организации: бухгалтерский учет и налогообложениеКазенные учреждения: акты и комментарии для бухгалтераКазенные учреждения: бухгалтерский учет и налогообложениеОплата труда в государственном (муниципальном) учреждении: акты и комментарии для бухгалтераОтдел кадров государственного (муниципального) учрежденияРазъяснения органов исполнительной власти по ведению финансово-хозяйственной деятельности в бюджетной сфереРевизии и проверки финансово-хозяйственной деятельности государственных (муниципальных) учрежденийРуководитель автономного учрежденияРуководитель бюджетной организацииСиловые министерства и ведомства: бухгалтерский учет и налогообложениеУчреждения здравоохранения: бухгалтерский учет и налогообложениеУчреждения культуры и искусства: бухгалтерский учет и налогообложениеУчреждения образования: бухгалтерский учет и налогообложениеУчреждения физической культуры и спорта: бухгалтерский учет и налогообложение
20192020
НомерЛюбой
Электронная версия
| Учетный номер проверки | Тип проверка | Период проведения проверки | Наименование органа государственного контроля (надзора) | Цель проведения проверки | Результаты проверки |
| | Внеплановая проверка, выездная | С 07 августа- 10 сентября 2018г. | Главное управление МЧС России по Калининградской области | Проверка выполнения предписаний по устранению нарушений обязательных требований пожарной безопасности от 07.08.2017 №110/1/1. | Требования выполнены. Нарушений не выявлено |
391800612955 | Внеплановая проверка, выездная | С 06 — 31 августа 2018г. | Управление Федеральной службы по ветеринарному и фитосанитарному надзору по Калининградской области | Проверка проводилась с целью проверки помещений, зданий, сооружений, технических средств, оборудования, иных объектов, которые предполагается использовать соискателем лицензии при осуществлении лицензируемого вида деятельности ФГБОУ КИПКА. | Нарушений не выявлено |
391800590926 | Внеплановая проверка, документарная | С 26 июля – 08 августа 2018г. | Управление Федеральной службы по ветеринарному и фитосанитарному надзору по Калининградской области | Проверка проводилась с целью проверки сведений, указанных в заявлении о предоставлении лицензии на осуществление фармацевтической деятельности ФГБОУ КИПКА. | Нарушений не выявлено |
001800376242 | Внеплановая проверка, выездная | С 08 — 13 февраля 2018г. | Центральное управление Федеральной службы по экологическому, технологическому и атомному надзору | Проверка проводилась с целью контроля исполнения юридическим лицом, индивидуальным предпринимателем ранее выданного предписания от 20.10.2017 № 8.1-0628пл-П/0214-2017 (далее Предписание), срок для исполнения, которого истек 01.02.2018. | Отчет о выполнении предписания об устранении выявленных нарушений №8,1-0628пл-П/0214-2017 от 20. |
00170700608867 | Плановая проверка | С 01 — 20 октября 2017г. | Центральное управление Федеральной службы по экологическому технологическому и атомному надзору | ст. 29.1 Федерального закона от 26.03.2003 № 35-ФЗ «Об электроэнергетике», п. 1 ст. 28 Федерального закона от 23.11.2009 № 261-ФЗ «Об энергосбережении и о повышении энергетической эффективности и о внесении изменений в отдельные законодательные акты Российской Федерации», п.7 и п. 8 постановления Правительства Российской Федерации от 25.04.2011 № 318 «Об утверждении правил осуществления государственного контроля надзора за соблюдением требований законодательства об энергосбережении и о повышении энергетической эффективности и о внесении изменений в некоторые акты Правительства Российской Федерации» | Предписано устранить нарушения обязательных требований правил, а именно: для непосредственного выполнения обязанностей по организации и эксплуатации электроустановок не назначен установленным порядком заместитель ответственного за электрохозяйство из числа руководителей и специалистов Потребителя после проведения проверки знаний и присвоения соответствующей группы по электробезопасности в комиссии органов госэнергонадзора. |
39170701847422 | Внеплановая проверка, выездная | С 19 июля – 15 августа 2017г. | Главное управление МЧС России по Калининградской области | Осуществления проверки за исполнением предписания ОНДиПР №195/1/118 от 12.10.2017 года по устранению нарушений обязательных требований пожарной безопасности, срок для исполнения которого истек | Не выполнение требований Правил противопожарного режима РФ в части необеспечение безопасности людей — высота выхода из лестничной клетки помещение №21 в соответствии с планом БТИ наружу, предусмотренного для эвакуации, составляет 1,74 м. |
39150500965748 | Плановая проверка | С 03-28 сентября 2015г. | Главное управление МЧС России по Калининградской области | Федеральный государственный пожарный надзор. Проверка соблюдения обязательных требований пожарной безопасности ФЗ 69 от 21.12.1994г., ст. 6.1. | Вынесено предписания об устранении выявленных нарушений в результате проведения КНМ № 164/1/141 от 28.09.2015г. |
| | Плановая проверка, выездная | С 03-30 сентября 2015г. | Министерство образования Калининградской области | Проверка соблюдения институтом требований законодательства Российской Федерации при осуществлении образовательной деятельности. | Вынесено предписание об устранении нарушений за № 30/09/16 от 30. |
Page not found — Детская художественная школа Пушкино
Unfortunately the page you’re looking doesn’t exist (anymore) or there was an error in the link you followed or typed. This way to the home page.
Blog
- 04/21/2018 — Прошёл 10 Областной теоретический конкурс по истории изобразительного искусства «ДОРОГОЙ ИСКУССТВА»
- 12/27/2017 — Карнавал 2017-2018 г. Парад костюмов!
- 12/16/2017 — Выставка «Преподобный Сергий Радонежский в русском изобразительном искусстве»
- 12/09/2017 — Совместный прект Пушкинской детской музыкальной школы № 1 и Пушкинской детской художественной школы «Времена года»
- 11/29/2017 — Открытие муниципальной выставки-конкурса «Зорко одно лишь сердце»
- 09/16/2017 — Акция «Наш лес.Посади своё дерево»
- 08/26/2017 — День города Пушкино 2017
- 06/15/2017 — Торжественное вручение свидетельств выпускникам 2017
- 05/03/2017 — Выставка обучающихся МБУДО Пушкинская ДХШ «Помнит мир спасённый»
- 04/29/2017 — Акция «Лес Победы»
- 04/22/2017 — В МБУДО Пушкинская ДХШ прошел Московский областной конкурс по истории изобразительного искусства «Дорогой искусства»
- 04/12/2017 — Открылась выставка работ младшего отделения «Ступени», посвященная Дню космонавтики.

- 03/31/2017 — Наши ученики приняли участие в I межрегиональной олимпиаде по МХК
- 03/28/2017 — Урок в Третьяковской галерее.
- 02/11/2017 — Вечер встречи выпускников
- 01/30/2017 — «Моя первая выставка». Персональная выставка учащейся 4″Б» класса Фохт Елизаветы.
- 12/28/2016 — Ежегодный конкурс «Новогодний калейдоскоп».
- 12/27/2016 — Новогодний вечер для отделения платных услуг «Ступени» с награждением грамотами наиболее отличившихся обучающихся.
- 12/26/2016 — Прошли просмотры обучающихся основного отделения и подготовительных групп
- 12/08/2016 — Выставка «Графические фантазии»
- 09/30/2016 — Сегодня на здании Пушкинской детской художественной школы открыли барельеф в честь Сергея Семёновича Рубцова.
- 06/20/2016 — Выпускной. Вручение свидетельств.
- 06/15/2016 — Пленэр и экскурсия в Архангельском
- 06/10/2016 — Защита дипломных работ 2016
- 04/23/2016 — 8-ой областной конкурс «Дорогой искусства»
- 04/16/2016 — 16 апреля три наших ученицы, Ксения Фонарёва, Катя Лучко, Яна Удинцева, приняли участие в областном очном конкурсе набросков, проводимом в Московском академиче
- 04/05/2016 — Все дети талантливы.
 Межзональный конкурс в ДХШ им.Е.А.Кольченко, Мытищи.
Межзональный конкурс в ДХШ им.Е.А.Кольченко, Мытищи. - 03/19/2016 — Внутришкольный академический конкурс учебного наброска «Фигура человека»
- 02/27/2016 — Экскурсия в музей изобразительных искусств им.Пушкина для обучающихся младшего подготовительного отделения «Ступени»
- 01/18/2016 — Строим снежную горку.
- 12/29/2015 — 28-29 декабря прошёл просмотр учебных работ за 1 полугодие основных классов.
- 12/26/2015 — Прошло торжественное мероприятие по окончанию 1 полугодия, где были награждены лучшие учащиеся: участники и победители различных конкурсов.
- 12/23/2015 — В Межпоселенческой библиотеке Пушкинского района Московской области (г. Пушкино, ул. Тургенева, д. 24) открылась выставка работ учащихся Пушкинской детской ху
- 12/21/2015 — Открылась ежегодная выставка «Новогодний калейдоскоп»
- 12/11/2015 — Экскурсия в Музейный комплекс «Конный двор», г. Сергиев Посад
- 12/08/2015 — Пушкинская детская
художественная школа приняла участие во Всероссийской антинаркотической акции
«За здоровье и безопасность наших детей».

- 11/12/2015 — Внутришкольный конкурс на лучший СКЕТЧБУК
- 10/19/2015 — Внутришкольная выставка отделения платных образовательных услуг «Ступени» групп раннего эстетического развития «Золотая осень»
- 10/14/2015 — Поездка на экскурсию в музей-усадьбу «Кусково»
- 10/07/2015 — Познавательная экскурсия во Всероссийский государственный университет кинематографии имени С. А. Герасимова
- 09/30/2015 — Пленэр в музее-заповеднике Царицыно
- 09/29/2015 — экскурсия в «Союзмультфильм»
- 09/07/2015 — Грандиозный пленэр в «Орленке». «Россия процветает».
- 06/18/2015 — Выпускники 2015
- 06/11/2015 — Пленэр в Сергиевом Посаде
- 06/05/2015 — Пленэр 2015. Боголюбская церковь.
- 05/28/2015 — Детский сабантуй
- 04/21/2015 — 7 Московский областной теоретический конкурс по истории искусств ДОРОГОЙ ИСКУССТВА
- 12/09/2014 — Юные художники рисуют авиалесоохрану
- 10/24/2014 — Нам 45 лет
- 09/13/2014 — Акция «Наш лес. Посади свое дерево» осенью 2014 г.

О порядке проведения контролирующими органами проверок в отношении органов местного самоуправления
О порядке проведения контролирующими органами проверок в отношении органов местного самоуправления
Федеральным законом №370-ФЗ внесены изменения в ст. 77 Федерального закона от 06.10.2003 № 131-ФЗ «Об общих принципах организации местного самоуправления в Российской Федерации (далее -Закон №131-ФЗ) по вопросу осуществления полномочий по контролю за деятельностью органов местного самоуправления и должностных лиц органов местного самоуправления. Данные изменения вступили в силу с 01.01.2014.
На органы прокуратуры возложены дополнительные полномочия по формированию ежегодного плана проведения проверок деятельности органов местного самоуправления и должностных лиц местного самоуправления (далее – план), а также по согласованию проведения внеплановых проверок в отношении названных субъектов правоотношений.
При этом следует иметь в виду, что к данным мероприятиям по контролю требования Федерального закона от 26.12.2008 №294-ФЗ «О защите прав юридических лиц и индивидуальных предпринимателей при осуществлении государственного контроля (надзора) и муниципального контроля» не применяются.
Новой редакцией ст. 77 Закона №131-ФЗ установлены периодичность проведения плановых проверочных мероприятий, порядок направления, рассмотрения проектов планов органов государственного контроля (надзора о проведении проверок, перечень сведений, включаемых в ежегодный план проведения плановых проверок, а также обязанность размещения на официальных сайтах прокуратуры субъекта Российской Федерации и соответствующего органа государственного контроля (надзора) плана не позднее 1 ноября года, предшествующего году проведения проверок.
Кроме того, планы органов контроля подлежат согласованию с прокуратурой субъекта Российской Федерации.
В целях реализации указанных полномочий прокуратуры субъектов Российской Федерации к 1 сентября текущего года (в последующем ежегодно к 1 сентября) должны обеспечить предоставление контролирующими органами проектов планов на 2017 год.
Внеплановые проверки деятельности органов местного самоуправления и должностных лиц местного самоуправления проводятся органами государственного контроля (надзора) на основании решения руководителя соответствующего органа государственного контроля (надзора) после согласования с прокуратурой (прокурором (его заместителем) субъекта Российской Федерации.
Основанием для проведения внеплановой проверки являются обращения граждан, юридических лиц, информация от государственных органов о фактах нарушений законодательства Российской Федерации, влекущих возникновение чрезвычайных ситуаций, угрозу жизни и здоровью граждан, массовые нарушения прав граждан, а также поручения Президента Российской Федерации, Правительства Российской Федерации, прокурора субъекта Российской Федерации о проведении внеплановой проверки в рамках надзора за исполнением законов по поступившим в органы прокуратуры материалам и обращениям.
Информация о результатах проведенной проверки деятельности органов местного самоуправления и должностных лиц местного самоуправления, в том числе о выявленных нарушениях и предписаниях об их устранении (с указанием сроков устранения), в течение месяца подлежит размещению на официальном сайте соответствующего органа государственного контроля.
Помощник прокурора
юрист 1 класса Е.М. Рощупкина
Дата создания: 16.06.2017 14:56
Дата последнего изменения: 18.12.2020 16:31
На главную страницу
Введен мораторий на проверки деятельности предпринимателей – Газета.uz
В Узбекистане сроком на два года объявлен мораторий на проведение проверок финансово-хозяйственной деятельности субъектов предпринимательства, за исключением проверок, проводимых в рамках уголовных дел и в связи с ликвидацией юридического лица. Это предусмотрено указом Президента от 22 января, которым утверждена Государственная программа «Год поддержки активного предпринимательства, инновационных идей и технологий».
В соответствии с документом, с 1 апреля 2018 года упраздняется Республиканский совет по координации деятельности контролирующих органов с передачей органам прокуратуры высвобождаемых 228 штатных единиц органов государственной налоговой службы.
С этой же даты исключаются дублирующие функции и полномочия органов юстиции по защите прав и законных интересов субъектов малого бизнеса, частного предпринимательства, иностранных инвесторов и предприятий с иностранными инвестициями.
Проверка финансово-хозяйственной деятельности (ревизия), проводимая в рамках уголовных дел, с 1 апреля не должна превышать одного месяца (в исключительных случаях срок проверки может быть продлен не более чем на месяц генеральным прокурором Узбекистана или его заместителем).
Возбуждение уголовных дел по фактам, связанным с правонарушениями при осуществлении предпринимательской деятельности, с апреля будет производиться исключительно с согласия прокурора Республики Каракалпакстан, прокуроров областей, города Ташкента и приравненных к ним прокуроров.
Сведения о нарушениях в деятельности субъектов предпринимательства, информация о проведенных проверках и мониторинге (основание, время проведения проверок или мониторинга, работники, их проводившие, и другие) и принятых мерах по устранению выявленных нарушений в обязательном порядке будут вводиться в специальную электронную информационную систему органов прокуратуры.
Указом Торгово-промышленной палате (ТПП), Министерству юстиции и другим ведомствам поручено разработать проект закона, предусматривающий действенные механизмы общественного контроля в целях предупреждения правонарушений в сфере предпринимательской деятельности.
Государственному налоговому комитету совместно с ТПП и другими ведомствами предписано в месячный срок утвердить программу комплексных мер по профилактике правонарушений, доведению и разъяснению норм законодательства в сфере предпринимательской деятельности.
Генеральной прокуратуре поручено усилить надзор за исполнением законодательства в сфере предпринимательской деятельности, прежде всего по защите прав и законных интересов субъектов предпринимательства, иностранных инвесторов и предприятий с иностранными инвестициями, обеспечив безусловную реализацию принципа неотвратимости ответственности виновных лиц по каждому факту правонарушения.
Соглашение о взаимном признании (MRA) | FDA
Соглашения о взаимном признании (MRA) между FDA и иностранными регулирующими органами позволяют инспекторам по лекарственным средствам полагаться на информацию, полученную в результате проверок лекарственных средств, проводимых в пределах границ друг друга. В соответствии с Законом о безопасности и инновациях Управления по санитарному надзору за качеством пищевых продуктов и медикаментов, принятым в 2012 году, FDA имеет право заключать соглашения о признании проверок лекарственных средств, проводимых иностранными регулирующими органами, если FDA определит, что эти органы способны проводить проверки, соответствующие требованиям U.С. требования.
MRA:
- Повышение эффективности регулирующих систем США и других стран за счет исключения дублирования проверок; и,
- Позволяет перераспределить ресурсы на инспекцию предприятий по производству лекарств с потенциально более высоким риском для здоровья населения во всем мире.
FDA имеет соглашения MRA с ЕС и Соединенным Королевством соответственно. FDA и ЕС сотрудничают с мая 2014 года, чтобы оценить способы, которыми каждый регулирующий орган проверяет производителей лекарств и оценивает риски и преимущества взаимного признания проверок лекарственных средств.FDA продолжает сотрудничество с Соединенным Королевством, так как оно вышло из ЕС с 1 января 2021 года.
FDA продолжит проводить некоторые инспекции в зарубежных странах с помощью компетентных инспекций, такие как инспекции оценки производства продукции для поддержки решений об утверждении маркетинга. Однако FDA рассчитывает проводить меньше обычных контрольных проверок в зарубежных странах с компетентной инспекцией.
Согласно действующим соглашениям о взаимном признании, FDA сотрудничает с инспекциями в ЕС и Великобритании и изучает их недавние отчеты о проверках и соответствующую информацию, чтобы определить соответствие производителя требованиям U.S. market вместо инспекции места FDA.
Страна признана 11 июля 2019 г.
| Страна | Регулирующий орган лекарственных средств для человека * |
|---|---|
| Словакия | Государственный институт по контролю за наркотиками / Štátny ústav pre kontrolu liečiv (ŠÚKL) ** |
Страна признана 26 июня 2019 г.
| Страна | Регулирующий орган лекарственных средств для человека * |
|---|---|
| Германия | Zentralstelle der Länder für Gesundheitsschutz bei Arzneimitteln und Medizinprodukten (ZLG) |
10 июня 2019 г.
| Страна | Регулирующий орган лекарственных средств для человека * |
|---|---|
| Люксембург | Minìstere de la Santé, Division de la Pharmacie et des Médicaments |
| Нидерланды | Инспекция здравоохранения / Inspectie voor de Gezondheidszorg (IGZ) |
стран признаны 29 апреля 2019 г.
| Страна | Регулирующий орган лекарственных средств для человека * |
|---|---|
| Болгария | Болгарское агентство по наркотикам ИЗПЪЛНИТЕЛНА АГЕНЦИЯ ПО ЛЕКАРСТВАТА |
| Кипр | Министерство здравоохранения — фармацевтические услуги Φαρμακευτικές Υπηρεσίες, πουργείο Υγείας |
7 февраля 2019 г.
| Страна | Регулирующий орган лекарственных средств для человека * |
|---|---|
| Польша | Главная фармацевтическая инспекция / Główny Inspektorat Farmaceutyczny (GIF) |
| Словения | Агентство по лекарственным средствам и медицинским изделиям Республики Словения Javna aggija Republike Slovenije za zdravila in medicinske pripomočke (JAZMP) |
Страна признана 28 ноября 2018 г.
| Страна | Регулирующий орган лекарственных средств для человека * |
|---|---|
| Эстония | Государственное агентство лекарственных средств / Равимиамет |
Страны признания 16 ноября 2018 г.
| Страна | Регулирующий орган лекарственных средств для человека * |
|---|---|
| Бельгия | Федеральное агентство по медицинским товарам и товарам для здоровья / Fedraal Agentschap voor geneesmiddelen en gezondheidsproducten / Fédérale des médicaments et produits de santé |
| Дания | Датское агентство по лекарственным средствам / Laegemiddelstyrelsen |
| Финляндия | Финское агентство по лекарственным средствам / Lääkealan turvallisuus- ja kehittämiskeskus (FIMEA) |
| Латвия | Государственное агентство лекарств / Zāļu valsts aģentūra |
Страна признана 14 сентября 2018 г.
| Страна | Регулирующий орган лекарственных средств для человека * |
|---|---|
| Португалия | Национальное управление лекарственных средств и товаров медицинского назначения / ИНФАРМЕД, I.P / Autoridade Nacional do Medicamento e Produtos de Saúde, I.P |
стран признаны 1 июня 2018 г.
| Страна | Регулирующий орган лекарственных средств для человека * |
|---|---|
| Ирландия | Регулирующий орган по продуктам здравоохранения (HPRA) |
| Литва | Государственное агентство по контролю за лекарствами / Valstybinė vaistų kontrolės tarnyba |
стран признаны 1 марта 2018 г.
| Страна | Регулирующий орган лекарственных средств для человека * |
|---|---|
| Греция | Национальная организация по лекарствам |
| Венгрия | Национальный институт фармации и питания |
| Чешская Республика | Государственный институт наркоконтроля |
| Румыния | Национальное агентство по лекарствам и медицинским приборам |
стран, признанных 1 ноября 2017 г.
| Страна | Регулирующий орган лекарственных средств для человека * |
|---|---|
| США | Управление по санитарному надзору за качеством пищевых продуктов и медикаментов |
| Австрия | Австрийское агентство по охране здоровья и безопасности пищевых продуктов / Österreichische Agentur für Gesundheit und Ernährungssicherheit (GmbH) |
| Хорватия | Агентство лекарственных средств и медицинских изделий / Agencija za lijekove i medicinske proizvode (HALMED) |
| Франция | Французское национальное агентство по безопасности лекарственных средств и товаров медицинского назначения / Национальное агентство безопасности лекарственных средств и продукции для здоровья |
| Италия | Итальянское агентство по лекарственным средствам / Agenzia Italiana del Farmaco |
| Мальта | Регулирующий орган по лекарственным средствам *** |
| Испания | Испанское агентство по лекарствам и медицинскому оборудованию / Agencia Española de Medicamentos y Productos Sanitarios |
| Швеция | Агентство медицинских товаров / Läkemedelsverket |
| Соединенное Королевство | Агентство по регулированию лекарственных средств и товаров медицинского назначения |
Ресурсы
* Ограничения: Определение возможностей относится к обычным инспекционным инспекциям.В будущем в действие соглашения могут быть включены следующие виды продукции и инспекции, ожидающие дальнейшего рассмотрения:
- Вакцины для человека
- Фармацевтические препараты, полученные из плазмы
- Исследуемые продукты (материалы клинических исследований)
- Ветеринарные товары
Из области действия MRA исключены: лекарственные препараты для современной терапии (ATMP), человеческая кровь, человеческая плазма, человеческие ткани и органы, а также ветеринарные иммунологические препараты.
** Словакия — только для инспекций химически синтезированных активных фармацевтических ингредиентов, предназначенных для использования в лекарственных препаратах для перорального введения человеку и производимых на специализированном предприятии, выпускающем один продукт.
*** Мальта — возможность не распространяется на стерильные или обработанные в асептических условиях лекарственные средства и биологические продукты; и нестерильные сильнодействующие лекарственные препараты.
Текущее содержание по состоянию на:
Нормативно-правовое обеспечение и инспекции — ОЭСР
| | Нормативно-правовое обеспечение и инспекции в природоохранном секторе Перу (2020) Первый обзор правоприменения и инспекций ОЭСР оценивает политику и правовую базу Агентства экологической оценки и правоприменения Перу, а также его практику и ресурсы, используемые в правоприменительной и инспекционной деятельности.Он также предлагает варианты политики для повышения производительности. Инструментарий ОЭСР по обеспечению соблюдения нормативных требований и инспекций использовался в качестве эталона для оценки, и обзор соответствует структуре 12 критериев Инструментария. |
Инструментарий ОЭСР по обеспечению соблюдения нормативных требований и инспекций (2018) То, как регулирующие нормы реализуются и соблюдаются, и как обеспечивается и продвигается соблюдение, являются критически важными факторами, определяющими, работает ли регулирующая система так, как задумано.Инспекции — один из наиболее важных способов обеспечения соблюдения нормативных требований и обеспечения соблюдения нормативных требований. Основанный на «Принципах передовой практики нормативного правоприменения и инспекции» ОЭСР 2014 года, этот инструментарий предлагает государственным чиновникам, регулирующим органам, заинтересованным сторонам и экспертам простой инструмент для оценки системы инспектирования и правоприменения в данной юрисдикции, учреждении или структуре. Контрольный список из 12 критериев может быть использован для определения сильных и слабых сторон, оценки фактических результатов и выявления областей для улучшения. | |
| Принципы наилучшей практики регулирования регуляторной политики ОЭСР 2014 года: обеспечение соблюдения нормативных требований и проверки направлены на создание всеобъемлющей основы для поддержки инициатив по совершенствованию нормативного правоприменения с помощью проверок, что сделает их более эффективными, действенными, менее обременительными для проверяемых и в то же время менее требовательны к ресурсам для правительств. Принципы касаются разработки политики, институтов и инструментов для обеспечения эффективного соблюдения требований, а также процесса реформирования инспекционных служб для достижения результатов. Отчет дополняет Рекомендацию Совета по регуляторной политике и управлению 2012 г. и предназначен для оказания помощи странам в реформировании инспекций и разработке сквозных политик по обеспечению соблюдения нормативных требований. Принципы имеют неофициальный необязательный статус руководства, утвержденного на уровне Комитета по регуляторной политике. |
Связанные публикации и семинар:
- Веб-семинар по инспекциям, правоприменению и нормативно-правовому обеспечению в период кризиса, 10 июня 2020 г.
- Нормативно-правовое обеспечение и инспекции в природоохранном секторе Перу, испанская версия, 29 апреля 2020 г.
- Исследование механизмов международного сотрудничества в области регулирования (IRC) в области качества воздуха, Рабочий документ No.12, Январь 2020
- Политика, нормативно-правовая база и обеспечение соблюдения для управления качеством воздуха, январь 2020 г.
- Конференция ОЭСР по правоприменению и инспекциям, 9 ноября 2017 г.
- Нормативная политика в Литве: акцент на стороне поставки, июль 2015 г.
- Семинар по нормативному надзору, Бразилиа, ноябрь 2015 г.
Для получения дополнительной информации , пожалуйста, свяжитесь с Дэниелом Трнка, старшим аналитиком политики, Отдел регуляторной политики, ОЭСР.
Подробнее о
Нормативные проверки | Novartis
Мы регулярно участвуем в проверках регулирующих органов, чтобы гарантировать высочайшее качество нашей деятельности в области разработки, производства и распространения.На программы проверок органов здравоохранения также повлияла пандемия COVID-19, при этом некоторые проверки были отложены или проводились удаленно. Компания Novartis подверглась 19 дистанционным проверкам, каждая из которых дала приемлемые результаты. Отложенные проверки будут проводиться как можно скорее на основании оценки риска и пользы ответственным органом здравоохранения. В 2020 году внешними органами здравоохранения (например, FDA, EMA) было проведено 126 инспекций. Все, кроме одного, были признаны хорошими или приемлемыми (99.2%). Единственная проверка, которая может потребовать дальнейшего улучшения, связана с повышенным вниманием к нашей клинической деятельности. Окончательная классификация этой проверки органами здравоохранения еще не определена.
Все регулирующие органы | 2016 | 2017 | 2018 | 2019 | 2020 |
|---|---|---|---|---|---|
Проверки | 206 | 217 | 202 | 187 | 126 |
% Проверки считаются приемлемыми | 98.1 | 99,1 | 98,5 | 96,8 | 99,2 |
Проверки FDA | 26 | 30 | 18 | 19 | 6 |
Предупреждающие письма FDA | 0 | 0 | 0 | 0 | 0 |
Форма 483 FDA | 14 | 14 | 8 | 11 | 1 |
Проверки спонсоров FDA | 2016 | 2017 | 2018 | 2019 | 2020 |
|---|---|---|---|---|---|
Инспекции по ведению клинических исследований и фармаконадзору | 5 | 5 | 3 | 2 | 1 |
Номер VAI (указано добровольное действие) | 1 | 2 | 1 | 1 | 0 |
Количество OAI (указано официальное действие) | 0 | 0 | 0 | 0 | 0 |
2018 Нормативные проверки и сертификаты
26 ноября 2018 г.
Успешная инспекция FDA для CordenPharma Bergamo
CordenPharma рада сообщить, что наше предприятие по производству активных фармацевтических ингредиентов (API) CordenPharma Bergamo (IT) завершило четырехдневную общую инспекцию, проведенную U.Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) в сентябре 2018 г. Результаты проверки были закрыты (16 ноября) Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (16 ноября) и присвоены статус «VAI» (Указаны добровольные действия).
Эсуа Макниелл, директор по соответствию CordenPharma Group, комментирует: «Мы довольны результатами и быстрым закрытием инспекции FDA в CordenPharma Bergamo. Это четвертая успешная инспекция производственной площадки CordenPharma в 2018 году, которая отражает наш высокий уровень профессионализма, подлинности и соответствия нормативным требованиям cGMP, что полностью соответствует законам и постановлениям властей США.”
19 ноября 2018
CordenPharma объявляет об успешной повторной сертификации SafeBridge® в CordenPharma Colorado
CordenPharma Colorado успешно завершила повторный сертификационный аудит эффективных соединений, проводимый консультантами SafeBridge ® . Сертификация поддерживается с момента ее первого вручения в 2013 году.
Оценка на месте включала оценку физических характеристик завода, программ, средств контроля воздействия, процедур и практик, применяемых при производстве сильнодействующих активных фармацевтических ингредиентов (АФИ), состоящую из анализа более 60 элементов.
Согласно критериям, установленным программой SafeBridge ® , CordenPharma Colorado считается компетентной и опытной в безопасном обращении с сильнодействующими API и соединениями.
«Локализация сильнодействующих соединений — это многогранная задача, выходящая далеко за рамки установки хорошего оборудования для локализации. Сила нашей программы сдерживания демонстрируется нашим подходом во всех направлениях, включая инженерный контроль, культуру сдерживания, разработку процессов, предварительное планирование гигиены труда и непрерывный цикл выполнения сдерживания », — комментирует Робин Ливингстон , менеджер по окружающей среде и Здоровье и безопасность, CordenPharma Colorado.
«CordenPharma Colorado имеет долгую и успешную историю производства высокоэффективных API-интерфейсов с надежными процессами, позволяющими работать с соединениями значительно ниже 50 нг / м. 3 OEL. Повторная сертификация SafeBridge обеспечивает объективную и научно обоснованную оценку, дополнительно подтверждающую наши возможности для поддержки клиентов в решении любых проблем, с которыми они сталкиваются », — говорит Джейсон Бертола , директор Global Highly Potent & Oncology Platform CordenPharma International.
Посмотреть пресс-релиз
2 ноября 2018
Успешная инспекция FDA для CordenPharma, Швейцария
CordenPharma рада сообщить, что 2 ноября 2018 г. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) завершило 5-дневную инспекцию нашего производственного предприятия CordenPharma в Швейцарии. Инспекция была сосредоточена на процессах и документации для конкретных продуктов в производстве API-интерфейсов и различных фосфолипидов, используемых в качестве наполнителей, а также на общем обзоре нашей общесистемной системы качества.
Учреждение получило успешный ответ, при этом не сообщалось о наблюдениях FDA по форме 483. Инспектор особо отметил открытое, отзывчивое и позитивное поведение проверенных сотрудников, а также их высокий уровень профессионализма и компетентности. Также было признано, что проделана огромная качественная подготовительная работа.
Юрг Бургер, управляющий директор CordenPharma Switzerland, комментирует: «Мы гордимся выдающимся результатом недавней инспекции FDA, которая напрямую отражает неутомимую индивидуальную приверженность каждого отдельного сотрудника к своей повседневной работе в CordenPharma Switzerland.”
18 июля 2018
CordenPharma Caponago успешно завершила предварительную проверку FDA
CordenPharma рада сообщить, что в июле 2018 года наше предприятие по производству инъекционных препаратов CordenPharma Caponago (IT) завершило обширную предварительную инспекцию (PAI), проведенную FDA США. Учреждение получило форму FDA 483, которая ограничивалась несколькими незначительными замечаниями. Соответственно, инспектор FDA предложил статус с указанием добровольных действий (VAI), который предполагает одобрение всех задействованных продуктов, указанных в PAI, два из которых будут производиться на новой линии асептического розлива и отделки в CordenPharma Caponago.
Фабрицио Фьордиглио, управляющий директор CordenPharma Caponago, комментирует: «Мы довольны результатами инспекции FDA PAI в июле 2018 года, поскольку они отражают наш высокий уровень профессионализма и внимание к соблюдению требований cGMP во всех производственных процессах и процессах обеспечения качества в соответствии с законодательством. и постановления властей США ».
09 июля 2018
Успешная инспекция FDA для Plankstadt
CordenPharma рада сообщить, что в июле 2018 года на нашем производственном предприятии CordenPharma Plankstadt (DE) прошла общая проверка, проведенная FDA США.Учреждение получило успешный ответ, при этом не сообщалось о 483 наблюдениях FDA.
Франк Хенер, управляющий директор CordenPharma Plankstadt, комментирует: «Мы довольны результатами инспекции FDA в июле 2018 года, поскольку они отражают наш высокий уровень профессионализма, достоверности и соответствия нормативным требованиям cGMP, которые полностью соответствуют законам и постановлениям власти Соединенных Штатов ».
04 апреля 2018
Успешная инспекция FDA для CordenPharma Boulder
CordenPharma рада сообщить, что в марте 2018 года на нашем производственном предприятии CordenPharma в Боулдере (Колорадо, США) прошла общая инспекция, проведенная FDA США.Были оценены все системы качества. Учреждение получило успешный ответ, при этом не сообщалось о 483 наблюдениях FDA.
Брайан МакКудден, управляющий директор CordenPharma Boulder, комментирует: «Мы довольны результатами инспекции FDA, проведенной в марте 2018 года, поскольку они отражают нашу готовность соблюдать наивысший уровень соответствия нормативным требованиям cGMP и представляют собой важную веху для нашей компании CordenPharma Boulder. после приобретения у Pfizer в ноябре 2017 года.”
PIC / S принимает новое руководство по проверкам GMP
Опубликовано 11 мая 2018 г. | Захари Бреннан
Схема сотрудничества в области фармацевтических инспекций (PIC / S) объявила в этом месяце, что она приняла новое руководство по инспекциям надлежащей производственной практики (GMP), в котором излагается процесс «кабинетной оценки» зарубежных предприятий для выявления случаев, когда приемлемый уровень соответствие GMP может быть подтверждено и подтверждено без выездных проверок.Основываясь на проекте Международной коалиции регулирующих органов в области лекарственных средств (ICMRA), PIC / S заявила, что руководство предоставляет инструмент и структуру, призванную помочь компетентным органам (CA) определить приоритетность ресурсов для инспекций GMP для медицинских и ветеринарных лекарств.
«Спрос на инспектирование фармацевтических производств намного превышает то, что может выполнить любой CA, и эта структура поможет регулирующим органам управлять рисками качества продукции, создаваемыми все более сложной глобальной цепочкой поставок фармацевтических препаратов», — заявили в группе.
Основная особенность этого нового руководства, по словам PIC / S: «Это необязательное (т.е. применимое на добровольной основе) руководство высокого уровня как для ICMRA, так и для участвующих органов (PA) PIC / S, цель которого чтобы облегчить этот процесс оценки. Он не заменяет собой национальные / региональные руководства, процедуры или законы, где они существуют ».
Принятие PIC / S этого нового руководства подчеркивает усилия, предпринятые группой для улучшения обмена информацией об инспекциях между властями, которая, по словам PIC / S, на 2018 год включает более 900 запланированных инспекций.
«Процедура должна включать информацию, которая необходима для принятия обоснованного регулирующего решения о соблюдении требований на объекте, триггерах и факторах риска, которые могут привести к необходимости проведения инспекции, а также о том, как должна быть зарегистрирована оценка и результат», — сказал PIC / S. . «Целью оценки собранной информации является получение уверенности в том, что соответствие GMP было подтверждено принимающим центром сертификации и что нет других новых доказательств, которые потребовали бы проведения инспекции на месте запрашивающим центром сертификации.”
Группа отмечает, что две главы руководства были пересмотрены с целью включения требований по предотвращению перекрестного загрязнения. Изменение квалификации поставщиков также было внесено в другую пересмотренную главу.
Пересмотр был завершен Подкомитетом PIC / S по гармонизации GM (D) P, возглавляемым Полом Густафсоном (Канада / RORB). PIC / S сообщила, что пересмотренное руководство GMP вступит в силу 1 июля 2018 года и будет опубликовано на веб-сайте группы до его публикации.
«Всем участвующим органам PIC / S (и заявителям), не входящим в ЕС / ЕЭЗ, было предложено перенести пересмотренные главы PIC / S GMP Guide в свои собственные GMP-руководства», — заявила группа.
Другие обновления PIC / S
PIC / S также сообщила, что вместе с Всемирной организацией здравоохранения создала новую рабочую группу под руководством Австралийского управления терапевтических товаров (TGA) по пересмотру Приложения 2 (биологические препараты) к PIC / S Руководство по GMP для ознакомления с рекомендациями Европейской комиссии (ЕК) по GMP, относящимся к лекарственным средствам для современной терапии (ATMP), с целью выявления:
- «сильные и слабые стороны;
- законных опасений отрасли и регулирующих органов в отношении ATMP;
- областей GMP, применимых к ATMP, которые могут выиграть от модернизации, чтобы отразить текущее состояние производственных процессов и производственных параметров.Цель состоит в том, чтобы представить Комитету PIC / S рекомендацию по стратегии гармонизации, где это возможно, с руководящими принципами ЕС, одновременно устраняя предполагаемые опасения, высказанные участвующими органами PIC / S, которые привели к международным расхождениям в этой области ».
Целью данного руководства является определение позиции, которую должен занять инспектор во время проверки объектов GDP / GMP, и предназначено для содействия согласованному подходу к проверке, включая отчетность в отношении управления данными и целостности.
PIC / S также сообщила, что открыта регистрация на семинар PIC / S 2018 года на тему «Управление рисками на протяжении жизненного цикла продукта» (в Чикаго с 26 по 28 сентября 2018 года). Группа сообщила, что семинар предназначен только для контролирующих органов по лекарствам.
Встречи PIC / S в Женеве, Швейцария, 16-18 апреля 2018 г.
© 2021 Общество профессионалов в области нормативного регулирования.Отсутствие глобального соответствия требованиям GMP и их влияние на готовую фармацевтическую продукцию
В Индии отчет показал, что индийская фармацевтическая промышленность столкнется с нехваткой рабочих до 2022 года из-за неадекватного образования и подготовки для определенных должностей. Это также удерживает выпускников от выбора карьеры в этом секторе. В совокупности эти факторы вызывают цепную реакцию.
В крупных странах, таких как Индия, есть регулирующие органы для отдельных штатов и центральный регулирующий орган в столице. Это может создать бюрократические проблемы, особенно потому, что центральный регулирующий орган CDSCO и государственные RA имеют разные функции.
В США и FDA, и государственные органы сталкиваются с ограничениями в обеспечении соблюдения GMP. Так как, например, смешанные лекарства не должны быть одобрены FDA, агентство столкнулось со значительными проблемами при остановке трех аптек (ApothéCure, NuVision Pharmacy и Downing Labs), которые неоднократно отказывались проводить проверки и операции отзыва.Несмотря на многочисленные предупреждения, они продолжали нарушать правила GMP и продавать потенциально опасные лекарства до 2015 года.
Во многих юрисдикциях RA не имеют достаточных возможностей для проверки и мониторинга постоянно растущего числа производителей. В Китае около 2700 инспекторов GMP, и большинство из них перегружены работой.
Исследование, проведенное в 2009–2010 годах Комитетом Машелкара, показало аналогичные результаты в Индии. В 2014 году Генеральный контролер по наркотикам страны сообщил, что его 1500 инспекторов по наркотикам представляют только 7 человек.5% от общего количества. Власти штата Индии также должны бороться с неадекватной инфраструктурой, ресурсами и помощью со стороны CDSCO, что препятствует координации между властями штата и выполнению законодательства.
СМК
Комплексно разработанная и эффективно внедренная система менеджмента качества (СМК) является ключом к нормативному потенциалу. СМК включает в себя все необходимое для реализации политики организации в области качества и достижения целей в области качества.
Неэффективная система менеджмента качества, напротив, может поставить под угрозу возможности организации по проведению инспекций.Помимо нехватки кадров, слабое руководство помешало созданию высококлассной инспекционной группы в CFDA. В «Отчете о фармацевтических регулирующих органах Китая и доступе к рынкам», опубликованном в 2014 году, отмечается, что только 1800 инспекторов страны были моложе 50 лет, и только около 800 (28,5%) участвовали в более чем одной инспекции GMP за последние 10 лет. . Годовой отчет CFDA по инспекции лекарственных средств за 2015 год показал, что менее половины фармацевтических производителей прошли проверку на соответствие требованиям GMP в 2015 году (221), чем в 2014 году (584).
FDA США также столкнулось с проблемами при внедрении QMS. Один случай в 2012 году был связан со вспышкой грибкового менингита в нескольких штатах, в результате которой погибло 64 человека. Хотя были явные признаки того, что Центр приготовления смесей Новой Англии нарушил правила GMP, FDA США и Фармацевтический совет Массачусетса не смогли принять окончательных мер против аптеки. Позднее Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США попыталось решить эту проблему, разрешив аптекам производить ограниченный 30-дневный запас лекарств до выписки по рецепту.Однако это новое устройство создает проблемы со стабильностью из-за химической деградации и размножения микробов.
Гармонизация и сотрудничество
Расширение международной торговли представляет собой растущую потребность в разработке соответствующих, последовательных и глобально применимых стандартов качества для лекарственных средств в рамках существующей нормативной базы. Международные усилия были направлены на гармонизацию нормативных требований, процедур инспекции GMP и фармакопейных стандартов.
PIC / S
PIC / S направлен на гармонизацию процедур инспекции во всем мире путем разработки общих стандартов GMP и обеспечения обучения инспекторов. Он также способствует сотрудничеству и взаимодействию между РА посредством совместных программ посещений, управляемых инспекций и экспертных кругов. † PIC / S также способствует юридически обязывающим договоренностям, таким как соглашение о взаимном признании (MRA) между Сингапуром и Австралией о проверке GMP лекарственных средств и отраслевое MRA АСЕАН о проверке GMP для производителей лекарственных средств.Кроме того, PIC / S сотрудничает с профессиональными ассоциациями в проведении совместных учебных мероприятий и подписала соглашения о сотрудничестве с европейскими и международными организациями.
Благодаря экономии средств, техническому опыту и повышению эффективности контрактное производство FPP для развитых рынков значительно выросло.
Влияние PIC / S также растет в Азиатско-Тихоокеанском регионе. Из девяти РА, которые стали органами-участниками PIC / S за последние четыре года, семь были из этого региона.По крайней мере шесть других РА Азиатско-Тихоокеанского региона, включая Китай и Индию, также выразили заинтересованность в присоединении к PIC / S.
† Экспертные круги PIC / S способствуют обсуждениям и обмену информацией между инспекторами, специализирующимися в конкретных областях GMP. Экспертные круги регулярно встречаются для разработки проектов руководств и рекомендаций и предлагают обучение в своих соответствующих областях.
ICMRA
Согласно веб-сайту Международной коалиции регулирующих органов в области лекарственных средств (ICMRA), ICMRA является «добровольным органом исполнительного уровня, стратегическим координирующим, пропагандистским и руководящим органом регулирующих органов.Коалиция была создана в мае 2012 года «для решения текущих и возникающих проблем регулирования и безопасности медицины человека на глобальном, стратегическом уровне и на постоянной прозрачной, авторитетной и институциональной основе». Фонд ECA отмечает, что ICMRA «направлена на определение направлений и направлений деятельности, общих для миссий многих органов власти, определение областей для потенциального взаимодействия и, где это возможно, использование существующих инициатив (например, PIC / S, ICH, APEC) и ресурсов. . » В отличие от PIC / S, ICMRA охватывает более широкую сферу, включая GMP.
PDG
Производители, поставляющие продукцию по всему миру, должны подтвердить, что их ГЛС соответствуют фармакопейным спецификациям в разных странах. Гармонизация этих стандартов упростит процессы обеспечения качества (QA) и устранит избыточное тестирование. Фармакопейная дискуссионная группа (PDG) состоит из
человек.представителя Фармакопеи Европы, Японии и США. Он направлен на гармонизацию фармакопейных стандартов, включая монографии по фармацевтическим препаратам и отдельные общие главы.В настоящее время PDG собирается два раза в год и ежемесячно проводит статусные и технические телеконференции для продвижения своей работы.
ВОЗ была приглашенным наблюдателем PDG с 2001 года. Различные общие методы тестирования, согласованные PDG, с тех пор были адаптированы к Международной фармакопее ВОЗ и включены в шестое издание, опубликованное в 2016 году.
PQM
Программа содействия качеству лекарственных средств (PQM), учрежденная в 2009 году, помогает производителям решать экономические и технические проблемы при производстве ГЛС, соответствующих стандартам GMP Программы преквалификации лекарственных средств ВОЗ.PQM финансируется Агентством США по международному развитию (USAID) и реализуется Фармакопеей США. На сегодняшний день совместные усилия USP и USAID принесли пользу сообществам в более чем 35 странах.
PQM также работает с RA над созданием аккредитованных программ контроля качества и расширением возможностей различных национальных лабораторий контроля качества в соответствии с международными стандартами. PQM также совместно с ВОЗ и РА организует тренинги по процедурам тестирования GMP и QC.
| PIC / S | ВОЗ | США FDA | CFDA | CDSCO | SID и GP | |
|---|---|---|---|---|---|---|
| Персонал | ||||||
| Квалификация | Похожие | |||||
| Опыт | Похожие | |||||
| Обучение | Похожие | |||||
| Помещение | ||||||
| Борьба с вредителями | Похожие | |||||
| Чистый воздух / классификация помещений * | марки A – D | марки A – D | Классы 100–100 000 и классы ISO 5–8 | марки A – D | марки A – D | марки A – D |
| Пределы микробиологического мониторинга * | марки A – D | марки A – D | Классы 100–100 000 и классы ISO 5–8 | марки A – D | марки A – D | марки A – D |
| Перепад давления воздуха * | 10–15 Паскаль | 10–15 Паскаль | 10–15 Паскаль | Не указано | ≥ 15 Паскалей | 10–15 Паскаль |
| Частота контроля | ||||||
| Количество твердых частиц * | Обычно | Обычно | Каждую производственную смену | Ежедневно | Каждые 6 месяцев | Обычно |
| Скорость воздухообмена * | Не указано | Не указано | Каждую производственную смену | Не указано | Каждые 6 месяцев | Не указано |
| Перепад давления воздуха * | Не указано | Не указано | Каждую производственную смену | Не указано | Ежедневно | Обычно |
| Температура и влажность * | В зависимости от продукта и характера операций | В зависимости от продукта и характера операций | Каждую производственную смену | В зависимости от продукта и характера операций | Ежедневно | В зависимости от продукта и характера операций |
| Проверка целостности НЕРА-фильтра * | Не указано | Каждые 6–12 месяцев | Дважды в год | в плановом порядке; частота не указана | Каждый год | в плановом порядке; частота не указана |
| Производство | ||||||
| Квалификация и проверка | Похожие | |||||
| Контроль качества | ||||||
| Контрольные / ретенционные образцы | Похожие | |||||
| Проверка стабильности | Похожие | |||||
| Стандарты фармакопеи | Европейская или другие фармакопеи | Международная фармакопея | Фармакопея США | Китайская фармакопея | Индийская фармакопея | Государственная фармакопея РФ |
| Другое | ||||||
| Самодиагностика | Похожие | |||||
| Управление рисками качества | Похожие | Не упомянутые концепции QRM | Похожие | |||
| Документация и целостность данных | Похожие | |||||
| * Компоненты или подкомпоненты GMP применимы только для производства стерильных продуктов. | ||||||
Предлагаемые решения
QbD
QbD обеспечивает качество продукции и производственного процесса. Это научный подход к разработке фармацевтических препаратов, основанный на оценке рисков, который начинается с заранее определенных целей. Это отличается от традиционной системы GMP, в которой качество продукции достигается преимущественно путем тестирования конечной продукции.
QbD расширяет возможности производителя по выявлению основных причин производственных сбоев, сокращая недостатки GMP, возникающие из-за неспособности исследовать аномалии.Это также упрощает работу RA по обеспечению соблюдения требований GMP за счет уточнения критериев регулятивной проверки. Это очень важно, особенно когда регулирующие органы имеют ограниченные возможности регулирования, поскольку требуется меньшее количество инспекций. Другие методы, такие как ближняя инфракрасная и рамановская спектроскопия, также могут быть адаптированы для онлайн-измерения критических показателей качества.
Однако нехватка ресурсов и затрат часто создает проблемы для производителей и RA. Страны с развивающейся экономикой сталкиваются с проблемой нехватки обучения и стоимости оборудования.Западные компании автоматизируют производство по мере роста стоимости рабочей силы, в то время как страны с развивающейся экономикой по-прежнему полагаются на ручную обработку, которая несет в себе больший риск человеческой ошибки.
Целостность данных и защита от ошибок
ПринципыALCOA + сами по себе не могут устранить проблемы целостности данных. Для решения этих проблем требуется целостный подход, включающий как технический, так и человеческий контроль. Производственный персонал, ручные процессы и задействованные технологии должны быть улучшены.
Люди по своей природе склонны к изменчивости в приемах и суждениях. Подавляющее большинство заявленных дефектных лекарственных средств возникло в результате человеческой ошибки, а не технологических сбоев. Недостаточная осведомленность среди сотрудников и неэффективное обучение часто приводят к тому, что сотрудники не понимают важность целостности данных. Поскольку системы и процессы по своей сути несовместимы, люди должны обеспечивать соответствие, используя инструменты, системы и технологии. «Инженерия человеческого фактора» — это наука о проектировании систем, которые соответствуют человеческим возможностям и ограничениям в восприятии, познании и физических характеристиках.
Понимание инспекций предприятий общественного питания | doh
Обновлено 27 июня 2018 г.
Этот документ предназначен для предоставления рекомендаций и помощи тем, кто занимается проверками безопасности пищевых продуктов на предприятиях питания в округе Колумбия. Подтверждающая информация взята непосредственно из Title 25 DC Food and Food Operations.
Что такое отчеты медицинского осмотра?Онлайновая база данных отчетов об инспекции пищевых продуктов округа содержит доступный для поиска диапазон инспекций, проведенных Службой инспекции безопасности пищевых продуктов и гигиены с 2007 года по настоящее время.Выбранная проверка появится в виде документа PDF или HTML под определенным объектом. Файлы PDF — это инспекции, которые были загружены в систему с историческими целями. Проверки отчетов в формате HTML делятся на две категории: проверка была проведена после 1 июля 2010 г. ИЛИ проверка была введена непосредственно в систему из бумажной копии, оставленной с учреждением, начиная с 1 апреля 2010 г. Формат HTML — это предназначен для того, чтобы дать читателю ясно видимое представление о проведенной проверке.
Какова цель онлайн-базы данных?Начиная с 1 июля 2010 года, с 1 апреля 2010 года Отдел начал вводить проверки в цифровую систему проверки здоровья, чтобы документы можно было легко просматривать в Интернете. Все новые инспекции проверяются и утверждаются менеджером программы перед размещением в сети. Инспекции становятся доступными в Интернете после просмотра руководителем программы. Эта проверка может длиться от 24 часов до 7 дней в зависимости от указанных нарушений и другой информации, содержащейся в отчете.Информация о заявителе не доступна для всеобщего ознакомления по закону. Некоторые проверки подлежат более тщательной проверке и, следовательно, могут не отображаться в Интернете в течение некоторого времени. В некоторых случаях инспекция может быть удалена с сайта и опубликована позже.
Какая информация включается в отчет о проверке?Форма проверки состояния здоровья содержит следующую информацию:
Информация об учреждении : название предприятия, адрес, номер телефона, номер базовой бизнес-лицензии (BBL) и срок действия лицензии BBL, тип учреждения, тип проверки, адрес электронной почты, и категория риска появится в верхней левой части листа проверки.
В верхней правой части листа проверки приводится сводка критических и некритических нарушений, обнаруженных во время проверки. Часть «Исправлено на месте» (COS) указывает, что нарушение было исправлено на месте в ходе проверки, и поэтому не учитывается при возможной повторной проверке. Нарушение, которое не может быть исправлено на месте, приведет к повторной проверке или исправлению. Пятидневный повторный осмотр проводится, когда на предприятии питания есть критический элемент, который не был исправлен на месте во время первоначального осмотра.Уведомление об исправлении или повторной проверке за 45 дней генерируется, когда на предприятии общественного питания обнаруживается некритическое нарушение, которое не было исправлено во время первоначальной проверки. Дежурный сертифицированный менеджер по защите пищевых продуктов (CFPM) появится под сводкой, как только она будет введена в систему DHD. Если не отображается в этой области, CFPM будет введен в раздел комментариев инспектора, расположенный в нижней части листа.
Подрядчик по вывозу мусора, подрядчик по борьбе с вредителями и компания по сбору жира будут указаны в области под разделом CFPM.
Какие виды проверок проводят санитарные инспекторы?Тип проверки:
Обычный: Периодическая проверка без предварительного уведомления, проводимая в рамках действующей нормативной схемы на основе категории риска предприятия.
Последующая проверка: Это проверка с конкретной целью повторной проверки элементов, которые не соответствовали требованиям во время плановой проверки. Это может произойти через 5 или 1 день после первоначального обнаружения.
HACCP: Это проверка, при которой определяется, соблюдаются ли критические пределы критических контрольных точек. Эта проверка сосредоточена на тех частях правил, нарушения которых могут напрямую вызвать болезни пищевого происхождения.
Жалоба: Это проверка, проведенная в результате жалобы, полученной в отдел здравоохранения. Детали жалобы будут оценены и обсуждены с ответственным лицом.
Подготовка к эксплуатации: Этот тип проверки гарантирует, что объект соответствует «нормам» в отношении размещения раковин, холодильных и нагревательных элементов и других предметов, обнаруженных на объекте.Инспекция проводится перед открытием объекта для бизнеса. Обширное меню и обзор плана также проводятся до получения разрешения на открытие.
Продление лицензии: Этот тип инспекции проводится для того, чтобы пищевое предприятие могло продлить свою базовую лицензию на ведение бизнеса.
Другое: Другие инспекции будут включать инспекции по обучению и совместные инспекции с другими агентствами, такими как FDA и USDA.
Какие типы заведений питания проверяются?Тип заведения
Ресторан — Эта классификация применяется, если вы предоставляете услуги питания посетителям, которые заказывают и обслуживаются сидя (т.е., услуги официанта / официантки) и оплатить после еды. Эта классификация также применяется, если вы предоставляете эти услуги питания посетителям с любой комбинацией других услуг, таких как еда на вынос. Плата за лицензию для ресторанов зависит от количества посадочных мест в вашем заведении. Если ресторан предлагает танцы и / или живую развлекательную программу, вам потребуется дополнительное одобрение общественного зала
Поставщик провизии — Любое физическое или юридическое лицо, которое предоставляет и готовит еду, напитки или закуски с посудой для их сервировки, для использования и потребления в помещениях, отличных от того, где они были приготовлены.Банкетные залы с кейтерингом. Поставщики общепита, предлагающие алкогольные напитки, должны подать заявку на получение лицензии ABC.
Магазин деликатесов — Это относится к предприятиям, где еда, напитки или закуски готовятся, готовятся и продаются для потребления вне помещений.
Пищевые продукты — Эта классификация применяется, если вы продаете «расфасованные» продукты питания, приготовленные в лицензированном помещении, включая продукты, которые обычно можно найти в магазинах повседневного спроса, продуктовых магазинах и на заправочных станциях, например, крупы, закуски, упакованные сэндвичи и т. Д. аналогичные предметы.
Бакалея — Любое предприятие общественного питания, которое продает молоко, молочные продукты, яйца, мясо, птицу, рыбу, консервы, муку, сахар, овощи и другие продукты в их первоначальном состоянии — не приготовленные или приготовленные.
Школьный кафетерий — Эта классификация применяется к общественным, частным и частным школьным кафетериям, расположенным в округе Колумбия K -12. Еда готовится на месте и подается студентам.
Морское дело — Розничная торговля — Ваши основные продажи — рыба или морепродукты напрямую потребителям.
Marine — Оптовая торговля — Ваши основные продажи — рыба или морепродукты.
Пекарня — Эта классификация применяется, если вы продаете хлебобулочные изделия в розницу, а не для немедленного потребления и не на месте.
Гостиница — Эта классификация применяется, если у вас есть какое-либо здание, в котором не менее 30 жилых комнат зарезервированы исключительно для временных гостей, и где руководство или концессионер готовят еду на кухне в помещении, чтобы ее можно было съесть в столовой, которая вмещает не менее 30 человек и сообщается с вестибюлем.
Производство мороженого r — Эта классификация применяется, если вы производите мороженое, замороженные йогурты, замороженный лед, шербеты, замороженный тофу или другие замороженные десерты (кроме хлебобулочных изделий).
Продавец на заказ — Любой розничный торговец, продающий расфасованные пищевые товары.
Мобильная торговля — Любое лицо, ведущее торговую деятельность, которая продает любые продукты или вещества (включая напитки), предназначенные для потребления людьми, занимая общественное место на той части улицы или шоссе, которая усовершенствована, спроектирована или обычно используется для транспортных средств. путешествовать.
Как часто проверяются заведения общественного питания и какой критерий определяет частоту проверок?Присвоение категорий риска
Частота проводимых проверок зависит от категории риска конкретного предприятия. Категория риска в значительной степени определяется функцией и масштабом любого конкретного предприятия пищевой промышленности. Необъявленные плановые проверки проводятся чаще на объектах с более высоким уровнем риска, чем на объектах с более низким уровнем риска.Жалоба вызывает проверку независимо от присвоенной категории риска.
Категории риска следующие:
Высокий риск № 5 — Экстенсивное обращение с сырьевыми ингредиентами. Обработка пищевых продуктов на уровне розничной торговли, например копчение и консервирование; упаковка с пониженным содержанием кислорода для увеличения срока хранения.
High-Risk # 4 — Обширная обработка сырых ингредиентов. Процессы приготовления включают приготовление, охлаждение и разогрев потенциально опасных пищевых продуктов.Процессы питания включают предварительную подготовку к подаче на следующий день. В эту категорию будут входить учреждения, первичное население которых будет включать в себя лиц с ослабленным иммунитетом.
Умеренный риск # 3 — Обширное обращение с сырьевыми ингредиентами. Процесс приготовления включает приготовление, охлаждение и разогрев потенциально опасных продуктов. Для различных процессов требуется горячая и холодная выдержка потенциально опасных пищевых продуктов. Процессы питания включают расширенную подготовку к следующему дню, обслуживание ограничено 2 или 3 пунктами меню.Розничная торговля продуктами питания включает в себя отделы гастрономов и морепродуктов, предприятия по переработке пищевых продуктов в розницу.
Средний риск # 2 — Ограниченное меню (1 или 2 пункта меню) Предварительно упакованные сырые ингредиенты готовятся или готовятся по заказу. Розничная торговля продуктами питания не включает деликатесы или приготовленные / приготовленные и поданные немедленно. Хранение потенциально опасных продуктов в горячем и холодном виде ограничивается разовым приемом пищи. Процессы приготовления, требующие приготовления, охлаждения и разогрева, ограничиваются 1 или 2 потенциально опасными продуктами.
Низкий риск № 1 — Первично расфасованные, не потенциально опасные пищевые продукты. Ограниченное приготовление хот-догов и сосисок. Мобильные операции по производству мороженого.
Примечание: Уровень риска предприятия может быть изменен на основании повторяющихся недостатков, зарегистрированного / подтвержденного заболевания пищевого происхождения и / или предшествующего инспекционного анамнеза.
Виды нарушений:
Непосредственная опасность для здоровья: Нарушения, представляющие значительную угрозу или опасность для здоровья.Эти нарушения требуют немедленного исправления или немедленного закрытия заведения. Эти нарушения могут варьироваться от работы без горячей воды, серьезного температурного воздействия на пищу или заражения паразитами до отказа сертифицированного менеджера по питанию от дежурства в часы работы.
Факторы риска болезней пищевого происхождения: Центры по контролю и профилактике заболеваний (CDC) определили наиболее часто сообщаемые факторы, способствующие болезням пищевого происхождения. К пяти категориям относятся: продукты из утвержденных источников , неадекватные температуры приготовления , неправильные температуры выдержки , перекрестное загрязнение и плохая личная гигиена .
Надлежащие методы розничной торговли: Системы для контроля основных условий эксплуатации и санитарии на пищевом предприятии. Некоторыми примерами являются борьба с вредителями, обслуживание оборудования, водопровода, водоснабжения и физических объектов.
Приоритетные нарушения: положение Продовольственного кодекса, применение которого непосредственно способствует устранению, предотвращению или снижению до приемлемого уровня опасностей, связанных с болезнями пищевого происхождения или травмами, когда нет других положений, которые также более непосредственно контролируют опасность. как предметы с поддающейся количественной оценке мерой, демонстрирующей контроль над опасностями, такими как приготовление пищи, повторный нагрев, охлаждение и мытье рук.Такие элементы должны быть исправлены в срок, не превышающий 5 календарных дней после проверки.
Нарушения фонда приоритетности : положения Продовольственного кодекса, в которых приложение поддерживает, упрощает или разрешает использование одного (1) или нескольких приоритетных элементов, а также элемента, который требует целенаправленного включения определенных действий, оборудования или процедур со стороны руководства отрасли для достижения контроля над ними. факторы риска, способствующие заболеванию или травмам пищевого происхождения, такие как обучение персонала, инфраструктура или необходимое оборудование, планы HACCP, документация или ведение записей и маркировка.Такие элементы должны быть исправлены в срок, не превышающий 5 календарных дней после проверки.
Основные нарушения: положения Продовольственного кодекса, которые не определены в качестве приоритетного или приоритетного основного пункта; и это обычно относится к общей санитарии, операционному контролю, стандартным рабочим процедурам (SSOP) санитарии, помещениям или сооружениям, конструкции оборудования или общему техническому обслуживанию. Такие элементы должны быть исправлены в срок, не превышающий 14 календарных дней после проверки.
Уведомления на местах: Уведомления на местах обычно выпускаются для исправления нарушений с течением времени. Примером может служить строительная памятка для установки раковин и светильников. Уведомления могут также включать вывоз мусора, уничтожение и проверку сбора жира. Сроки обычно составляют от 24 часов до 45 дней.
Регулирующий фонд: DCMR Title 25, DC. Продовольственная и продовольственная промышленность. Взято из Типового пищевого кодекса FDA, вступившего в силу 6 июня 2003 г.
** Нарушения теперь классифицируются как приоритетные, основные приоритеты и основные и больше не классифицируются как критические и некритические. Тем не менее, для полного понимания при просмотре прошлых отчетов эта информация остается: Критические нарушения: Нарушения, если их не исправить, с большей вероятностью, чем другие нарушения, напрямую способствуют загрязнению пищевых продуктов, болезням или угрозе здоровью окружающей среды. Примеры критических нарушений включают плохой контроль температуры пищи, неправильное приготовление, охлаждение, охлаждение или повторный нагрев.Такие элементы должны быть исправлены в срок, не превышающий 5 календарных дней после проверки. Некритические нарушения: Эти типы нарушений, как правило, не связаны напрямую с причиной болезней пищевого происхождения, но, если их не исправить, могут помешать работе ресторана. Вероятность болезней пищевого происхождения в этих случаях очень мала. Некритические нарушения, если их не исправить, могут привести к критическим нарушениям. Примеры некритических нарушений включают отсутствие чистоты и обслуживания на предприятии или неправильную очистку оборудования и посуды.Такие элементы должны быть исправлены в срок, не превышающий 45 календарных дней после проверки.При каких условиях будет закрыто заведение?
Отдел инспекционных услуг Министерства здравоохранения, безопасности пищевых продуктов и гигиены закрывает предприятия питания при следующих условиях:
Приостановление действия лицензии из-за неминуемой опасности для здоровья: действие бизнес-лицензии приостанавливается, и дается директива о прекращении и прекращении использования небезопасных частей учреждение или все учреждение для обеспечения здоровья населения.Приостановление действует до тех пор, пока нарушения не будут устранены. Основания для закрытия из-за неминуемых рисков для здоровья населения могут включать, но не ограничиваются:
- Нет горячей воды
- Резервное копирование или перелив сточных вод
- Коммунальных услуг нет
- Пожар
- Заражение паразитами
- Загрязненные продукты питания
- Вспышка болезни пищевого происхождения
- Недостаточное охлаждение
- Наводнение
Исправлено на месте (COS)
Исправлено на месте — это новое положение, которое позволяет предприятию исправлять участки, которые можно исправить в разумные сроки.Примером исправленного нарушения на месте может быть подметание мусора из угла помещения или замена полотенец в раковине. Примером того, что не является нарушением COS, может быть ремонт и / или замена холодильника. Только те нарушения, которые не могут быть исправлены на месте, будут рассматриваться учреждением и засчитываться для их повторной проверки.
Несоответствие: Заведение может быть закрыто за то, что не решило и не исправило проблемы, выявленные в ходе предыдущей проверки.Изначально проблемы могли быть вызваны уведомлением за 5 или 14 дней. Неспособность исправить эти пункты может привести к приостановке или закрытию.
В чем разница между уведомлением за 5 дней (приоритет / приоритет) и уведомлением за 14 дней (основной)?Типы нарушений приоритета / приоритета Фонда — уведомления за 5 дней
Демонстрация знаний : Менеджер по защите пищевых продуктов и / или ответственное лицо должны продемонстрировать приемлемый уровень понимания в отношении профилактики болезней пищевого происхождения и требований Продовольственный кодекс округа Колумбия, когда инспектор задает вопросы на протяжении всей инспекции.Эти знания обычно получают на учебных курсах по сертификации в области безопасности пищевых продуктов.
Здоровье сотрудников : Ответственное лицо должно знать, когда ограничивать или исключать сотрудника, у которого проявляются симптомы болезни пищевого происхождения. О некоторых заболеваниях необходимо сообщать в отдел здравоохранения.
Надлежащая гигиеническая практика : Запрещается дегустация, курение, еда или питье в непосредственном контакте с местами производства или приготовления пищи. На употребление кофе и чая действуют определенные ограничения.Запрещается хранить личную пищу в непосредственном контакте с едой, подаваемой клиентам.
Руки как средство заражения : Между работами необходимо тщательно мыть руки. Необходимо соблюдать правильную процедуру и продолжительность. Избегайте контакта голыми руками с готовыми к употреблению продуктами.
Утвержденные источники : Продукты питания должны поступать из утвержденных источников из юрисдикций, где проводятся регулярные проверки.
Защита от загрязнения : Загрязнение может исходить от сотрудников, клиентов или других источников окружающей среды.Санитарная обработка поверхностей и оборудования, контактирующих с пищевыми продуктами, а также соблюдение правильных процедур мытья посуды может обеспечить соблюдение требований. Борьба с вредителями и отказ от небезопасных пищевых продуктов также могут предотвратить загрязнение пищевых продуктов.
Контроль времени и температуры потенциально опасных продуктов (PHF) : Во время приготовления, охлаждения, повторного нагрева, оттаивания и выдержки в горячем / холодном состоянии необходимо соблюдать надлежащий контроль температуры. Кроме того, должна присутствовать надлежащая маркировка даты и этикеток. Когда время используется в качестве контроля общественного здравоохранения, должны существовать письменные процедуры, которые должны соблюдаться.
Консультации для потребителей : Заведение должно уведомлять клиентов и постоянных посетителей, если они занимаются продажей сырых или недостаточно приготовленных продуктов. Типы продуктов, которые будут вызывать этот тип уведомления, — это суши, тартар из стейка или яйца «солнечной стороной вверх». Уведомление предназначено для информирования клиентов о повышенном риске заболевания из-за употребления этих продуктов, особенно при наличии предшествующих заболеваний.
Высокочувствительные группы населения : В тех заведениях, которые обслуживают лиц с ослабленным иммунитетом или очень восприимчивых к болезням пищевого происхождения, должны быть установлены определенные процедуры.Пастеризованные жидкие, замороженные или сухие яйца следует заменять сырыми яйцами. Расфасованный сок должен иметь предупреждающую этикетку. HACCP может быть реализован.
Ядовитые или токсичные материалы : Можно использовать только одобренные химические добавки. Химические вещества, используемые для чистки или продажи, следует хранить отдельно от пищевых продуктов.
Соответствие плану HACCP: при наличии плана HACCP будет проводиться мониторинг, чтобы гарантировать, что процедуры соблюдаются и при необходимости выполняются корректирующие действия.
Типы основных нарушений — 14-дневное уведомление
Физические сооружения : В соответствии с этим нарушением должны выполняться требования к конструкции здания. Включенные элементы будут включать надлежащее освещение, закрытие отверстий в помещении, полах, стенах, потолках и других вопросах, связанных с самой структурой.
Требования к водопроводу : В рамках этого нарушения рассматриваются вопросы предотвращения обратного потока и обратного сифонажа. В соответствии с этим правилом также могут указываться протекающие трубы или неправильно установленные раковины.
Туалеты : В заведении должны быть адекватные и подходящие туалеты для обоих полов. В ванных комнатах должны быть самозакрывающиеся двери и надлежащая вывозка мусора.
Контракты на утилизацию (мусор / мусор) и уничтожение : Предприятие должно предоставить инспектору доказательства вывоза, уничтожения и сбора жира (при необходимости). Эта информация обычно может быть получена из счетов-фактур или контрактов с компаниями.
Примечание. Настоящие правила не охватывают все области типовой проверки.Имейте в виду, что любой отчет о проверке является «снимком» дня и времени проверки. В любой день в заведении общественного питания может быть меньше или больше нарушений, чем указано в отчете. Проверка, проводимая в любой день, может не отражать общую долгосрочную чистоту предприятия. Кроме того, во время проверки нарушения регистрируются, но часто исправляются на месте до того, как инспектор покинет предприятие.
Какие правила отопления и охлаждения должны соблюдаться на предприятиях общественного питания?
DC Food Code Specifications
Минимальные температуры приготовления : Приготовление продуктов до нужной температуры — один из немногих способов уменьшить присутствие и рост патогенов.Температуру следует регулярно проверять, чтобы гарантировать соблюдение требований.
| Минимальная температура приготовления | Продукты питания / Описание |
|---|---|
| 165 ° F в течение 15 секунд | Птица, выловленная вживую или в полевых условиях, дичь, фаршированная рыба, мясо, свинина, макаронные изделия, домашняя птица или ратиты, а также фарш, содержащий рыбу, мясо, птицу или ратиты. Мясо включает крупный рогатый скот, свиней, коз и др. |
| 165 ° F с 2-минутной выдержкой после приготовления | Приготовление в микроволновой печи сырых продуктов животного происхождения: накрывать, переворачивать или перемешивать на протяжении или в середине процесса приготовления и выдерживать в течение 2 минут под крышкой. |
| 155 ° F в течение 15 секунд | Ratites, сырые яйца, инъекции мяса; измельченные сырые продукты животного происхождения, такие как рыба, мясо, промышленно выращиваемая и переработанная дичь, экзотические животные, кролики |
| 145 ° F в течение 15 секунд | Яйца в сырой скорлупе, предназначенные для немедленного использования |
| 145 ° F Температура поверхности (изменение цвета, указывающее на приготовление) | Цельномышечный стейк из говядины |
| 145 ° F в течение 3 минут | Целое жаркое из говядины, солонины, свинины или вяленой свинины. |
Требование горячего выдерживания
Горячие продукты должны храниться при температуре 135 ° F или выше.
Требования к хранению в холоде
Холодные продукты должны храниться при температуре 41 ° F или ниже.
Повторный нагрев для горячей выдержки
Остатки: 165 ° F
Промышленная переработка: 135 ° F в течение 2 часов
Охлаждение потенциально опасных продуктов
Горячие продукты: от 135 ° F до 70 ° F в течение 2 часов и от 70 ° F до 41 ° F в течение 4 часов.Температура окружающей среды: охлаждение до 41 ° F в течение 4 часов восстановленные продукты, консервы из тунца.
Холодный прием: закон, разрешающий транспортировку некоторых пищевых продуктов при температуре выше 41 ° F, должен быть охлажден до 41 ° F в течение 4 часов. Скорлупу яиц следует хранить при температуре 45 ° F.
Размораживание
Должно выполняться одним из трех способов:
a) При охлаждении до 41 ° F или ниже.
б) Как часть непрерывного процесса приготовления. Это включает приготовление в микроволновой печи.
c) Под проточной водой при температуре 70 ° F или ниже.
Маркировка даты, готовые к употреблению продукты, потенциально опасные продукты
Охлажденные, готовые к употреблению, потенциально опасные продукты, приготовленные на месте, и промышленно обработанные продукты, открытые для обслуживания, должны иметь маркировку даты, если они будут употреблены через 24 часа. Продукты можно хранить до 7 дней при температуре 41 ° F или ниже. Если продукты впоследствии замораживаются, при размораживании продукты должны быть:
или
- Отмечен новой датой «до потребления», учитывающей время простоя до замораживания.
Потенциально опасные продукты с просроченным сроком «до употребления» должны быть немедленно выброшены.



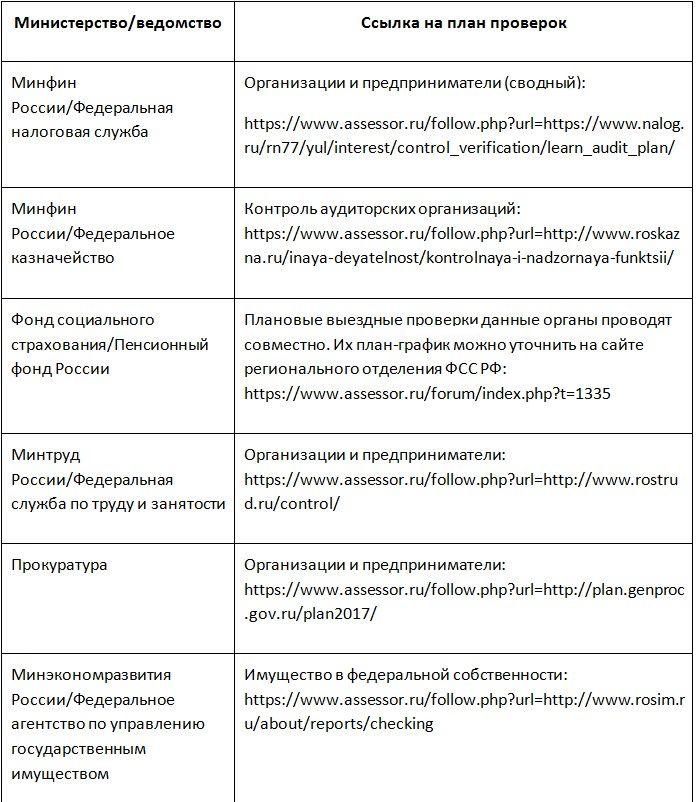 Стоит внимательно изучить новшества – чтобы применить в случае, если с проверкой все же нагрянут. Кроме того, не следует забывать, что всегда может быть проведена внеплановая проверка – по обращению заинтересованного лица и тогда сослаться на установленный мораторий не получится.
Стоит внимательно изучить новшества – чтобы применить в случае, если с проверкой все же нагрянут. Кроме того, не следует забывать, что всегда может быть проведена внеплановая проверка – по обращению заинтересованного лица и тогда сослаться на установленный мораторий не получится.

 10.2017 направлено в адрес контролирующего органа.
10.2017 направлено в адрес контролирующего органа. ПТЭЭП п.1.2.1., п.1.2.3., п.1.2.7., п.1.4.28. У Потребителя отсутствует (не создана) энергослужба (в зависимости от объема и сложности работ по эксплуатации электроустановок), укомплектованная соответствующим по квалификации электротехническим персоналом для эксплуатации электроустановок. Отсутствует также договор со специализированной организацией на эксплуатацию электроустановок. ПТЭЭП п.1.2.1.
ПТЭЭП п.1.2.1., п.1.2.3., п.1.2.7., п.1.4.28. У Потребителя отсутствует (не создана) энергослужба (в зависимости от объема и сложности работ по эксплуатации электроустановок), укомплектованная соответствующим по квалификации электротехническим персоналом для эксплуатации электроустановок. Отсутствует также договор со специализированной организацией на эксплуатацию электроустановок. ПТЭЭП п.1.2.1.
 09.2015. Отчет института об исполнении предписания за исх. № 76 от 17.03.2016 передан в контролирующий орган 20.03.2016 г.
09.2015. Отчет института об исполнении предписания за исх. № 76 от 17.03.2016 передан в контролирующий орган 20.03.2016 г. Межзональный конкурс в ДХШ им.Е.А.Кольченко, Мытищи.
Межзональный конкурс в ДХШ им.Е.А.Кольченко, Мытищи.
