№ 771903448178 от 16 сентября 2019 года Внеплановая документарная проверка Орган контроля (надзора), проводящий проверку Государственная инспекция труда в городе МосквеЦель проверки Защиты прав и интересов работников, в связи с рассмотрением обращения от 20.08.2019 №77/7-27586-19-ОБ, от 22.08.2019 №77/7-27765-19-ОБ. Задачами проверки являются: надзор и контроль за соблюдением законодательства и иных нормативных правовых актов, содержащих нормы трудового права. Предметом настоящей проверки является: — соблюдение обязательных требований и (или) требований, установленных муниципальными правовыми актами; — соответствие сведений, содержащихся в уведомлении о начале осуществления отдельных видов предпринимательской деятельности, обязательным требованиям; — соответствие сведений. содержащихся в заявлении и документах юридического лица или индивидуального предпринимателя о предоставлении правового статуса, специального разрешения (лицензии), выдачи разрешения (согласования) обязательным требованиям, а также данным об указанных юридических лицах и индивидуальных предпринимателях, содержащимся в едином государственном реестре индивидуальных предпринимателей и других федеральных информационных ресурсах; — выполнение предписаний органов государственного контроля (надзора), органов муниципального контроля; — проведение мероприятий; — по предотвращению причинения вреда жизни, здоровью граждан, вреда животным, растениям, окружающей среде, объектам культурного наследия (памятникам истории и культуры) народов Российской Федерации, музейным предметам и музейным коллекциям, включенным в состав Музейного фонда Российской Федерации, документам, имеющим особое историческое значение, научное, культурное значение, входящим в состав национального библиотечного фонда; — по предупреждению возникновения чрезвычайных ситуаций природного и техногенного характера; — по обеспечению безопасности государства; — по ликвидации последствий причинения такого вреда | Результат Нарушений не выявлено Информация о результатах проверки
|
отзывы врачей и сотрудников о работодателе
В клинику «Лимфа» я попала, чтобы вылечитьлимфедему руки после мастэктомии — она у меня
возникла 5 лет назад и, в течение 5-ти лет
нарастала и нарастала. Конечно, я обращалась в
обычную больницу, но реально они помочь
ничем не могли. О клинике «Лимфа» я узнала
что причиталось, что здесь лечат по методике
немецких врачей.
 И еще представители этой
И еще представители этойклиники брали на лечение больных женщин и
девушек. Я об этом тоже прочитала на сайте, и
смотрела ток-шоу «Говорим и показываем»,
«Прямой эфир», «Пусть говорят». Именно там я
увидела впервые Веру Сергеевну и Ивана
Геннадьевича, и ни разу не пожалела о том, что
поехала лечиться именно сюда, потому что здесь
реально оказывают помощь. Это правильная
клиника, где правильно лечат.
начальных классов. И, кончено, хотелось бы решить эту проблему, и проблему эту я решила.
Здесь работают мастера своего дела, профессионалы. И именно в этой клинике лечение
лимфодемы признано золотым стандартом лечения лимфодем. И очень мне понравилось еще
то, что клиника находится в тихом, спокойном районе Москвы, здесь очень много зелени, и
можно гулять, тут два рядом парка прекрасных, и здесь я не только лечилась, но еще отдыхала.
Тоже это большой плюс. Хочется пожелать руководству клиники дальнейших успехов во всем,
во всех начинаниях, процветания, стабильности, добиваться таких же результатов.

работники начинают руководство, заканчивая младшим персоналом. Очень внимательные,
тактичные, и идут легко на контакт, навстречу больным, и думаешь, что другим женщинам,
которые страдают этой же проблемой, я расскажу, куда обращаться, где можно получить
помощь. Отзывы у меня о лечении самые положительные, самые приятные. Спасибо, что в
России есть такая клиника, где реально помогают людям справиться с такой большой
проблемой.
Вологда.
https://www.youtube.com/watch?v=rn9-8Qh079M
| 1 | АлкоМед на Осеннем бульваре Специализированная клиника | 12.16 0.00 | отзывы | не определено | |
| 2 | Бест Клиник в Спартаковском переулке Многопрофильный медицинский центр | 12.04 0. | отзывы | высокие | |
| 3 | Бест Клиник на Новочерёмушкинской Многопрофильный медицинский центр | 11.54 0.00 | отзывы | высокие | |
| 4 | К+31 на Лобачевского Многопрофильный медицинский центр | 11.13 -0.01 | отзывы | очень высокие | |
| 5 | Санаре в Погонном проезде Детский медицинский центр | 11.08 0.00 | отзывы | высокие | |
| 6 | Клиника Семейная на Хорошевском шоссе | 11. 0.00 | отзывы | высокие | |
| 7 | Клиника Семейная на Героев Панфиловцев Многопрофильный медицинский центр | 11.05 0.00 | отзывы | высокие | |
| 8 | КБ МГМУ им. Сеченова Многопрофильный медицинский центр | 10.94 -0.01 | отзывы | высокие | |
| 9 | Поликлиника №6 Лечебно-диагностический центр | 10.88 -0.01 | отзывы | высокие | |
| 10 | Клиника Семейная на Каширском шоссе Многопрофильный медицинский центр | 10. -0.01 | высокие | ||
| 11 | Клиника Семейная на Университетском проспекте Многопрофильный медицинский центр | 10.69 0.00 | отзывы | высокие | |
| 12 | ↑ | Бест Клиник на Ленинградском шоссе Многопрофильный медицинский центр | 10.60 0.00 | отзывы | высокие |
| 13 | ↑ | Европейский МЦ на Щепкина Многопрофильный медицинский центр | 10.56 0.00 | отзывы | очень высокие |
| 14 | ↑ | Клиника Семейная на Сергия Радонежского Многопрофильный медицинский центр | 10. -0.01 | отзывы | высокие |
| 15 | ↑ | Клиника Семейная на Фестивальной Многопрофильный медицинский центр | 10.55 0.00 | отзывы | высокие |
| 16 | ↑ | Клиника Семейная на Первомайской Многопрофильный медицинский центр | 10.53 0.00 | отзывы | высокие |
| 17 | ↑ | Добромед на Братиславской Лечебно-диагностический центр | 10.47 -0.01 | отзывы | высокие |
| 18 | ↑ | Клиника Семейная на Ярославском шоссе Многопрофильный медицинский центр | 10. 0.00 | отзывы | высокие |
| 19 | Добромед на Братиславской 18 Лечебно-диагностический центр | 10.42 -0.01 | отзывы | средние | |
| 20 | ↑ | GMS Clinic на 2-й Ямской Многопрофильный медицинский центр | 10.41 0.00 | отзывы | очень высокие |
| 21 | ↑ | АО «Медицина» во 2-м Тверском-Ямском переулке Многопрофильный медицинский центр | 10.37 -0.01 | отзывы | очень высокие |
| 22 | ↑ | ЦЭЛТ на шоссе Энтузиастов Многопрофильный медицинский центр | 10. 0.00 | отзывы | высокие |
| 23 | ↑ | НМХЦ им. Пирогова на Нижней Первомайской 70 Многопрофильный медицинский центр | 10.31 -0.01 | отзывы | низкие |
| 24 | ↑ | Клиника №1 в Люблино Многопрофильный медицинский центр | 10.23 0.00 | отзывы | высокие |
| 25 | ↓ | МедикСити на Полтавской Многопрофильный медицинский центр | 10.21 -0.40 | отзывы | высокие |
| 26 | КДС Клиник на Белозерской Многопрофильный медицинский центр | 10. 0.00 | отзывы | средние | |
| 27 | Клиника Столица на Арбате Многопрофильный медицинский центр | 10.15 0.00 | отзывы | высокие | |
| 28 | МедЦентрСервис на Земляном Валу Лечебно-диагностический центр | 10.14 0.00 | отзывы | низкие | |
| 29 | Добромед на Грекова Лечебно-диагностический центр | 10.13 0.00 | отзывы | высокие | |
| 30 | Клиника Столица на Летчика Бабушкина Многопрофильный медицинский центр | 10. 0.00 | отзывы | высокие |
VI съезд лимфологов России «Эпоха возрождения», город Москва, 15-16 ноября 2017 года.
15 – 16 ноября 2017 года в отеле «Космос», в зале «Галактика» состоялся VI съезд лимфологов России «Эпоха возрождения».
Ведущий лимфолог клиники «МИФЦ» Малахов Алексей Михайлович принимал участие в работе съезда.
Малахов А.М. с сотрудниками НПЦ «Лимфа» Макаровым И.Г и Михалиным А.В.
Сертификат участника съезда лимфологов России
Открыл мероприятие Иван Васильевич Ярёма, д.м.н., профессор, член-корреспондент РАН, основатель отечественной клинической лимфологии (1967-2006) с докладом, в котором осветил основные этапы формирования лимфологической науки в России.
Открывает съезд член-корр. РАН, профессор, д.м.н. Ерема И.В.
В своем следующем сообщении Иван Васильевич поведал о возможностях трансфузии лимфы в определённых клинических ситуациях.
Иван Геннадьевич Макаров (Москва), руководитель медицинского и образовательного направления в НПЦ ЛИМФА, член Ассоциации Лимфологов России, автор методических рекомендаций для врачей и пациентов представил доклад на тему «Практическое развитие лимфологии в России».
Выступает Руководитель НПЦ «Лимфа» Макаров И.Г.
Особое внимание Иван Геннадьевич уделил современным тенденциям и перспективам этого направления медицины в нашей стране и за её пределами.
Марина Петровна Березко, врач лимфолог, к.м.н. (Москва) представила сообщении на тему «Использование перемежающейся пневмокомпрессии в комплексном лечении лимфедемы».
Докладывает к.м.н. Березко М.П.
В основу лекции были положены результаты собственного сравнительного клинического исследования терапии пациентов, перенесших хирургическое лечение рака молочной железы. В рамках исследования пациенты с наличием лимфедемы верхней конечности 2-3 стадии (по Фёльди) 50 человек были разделены на две группы (по 25).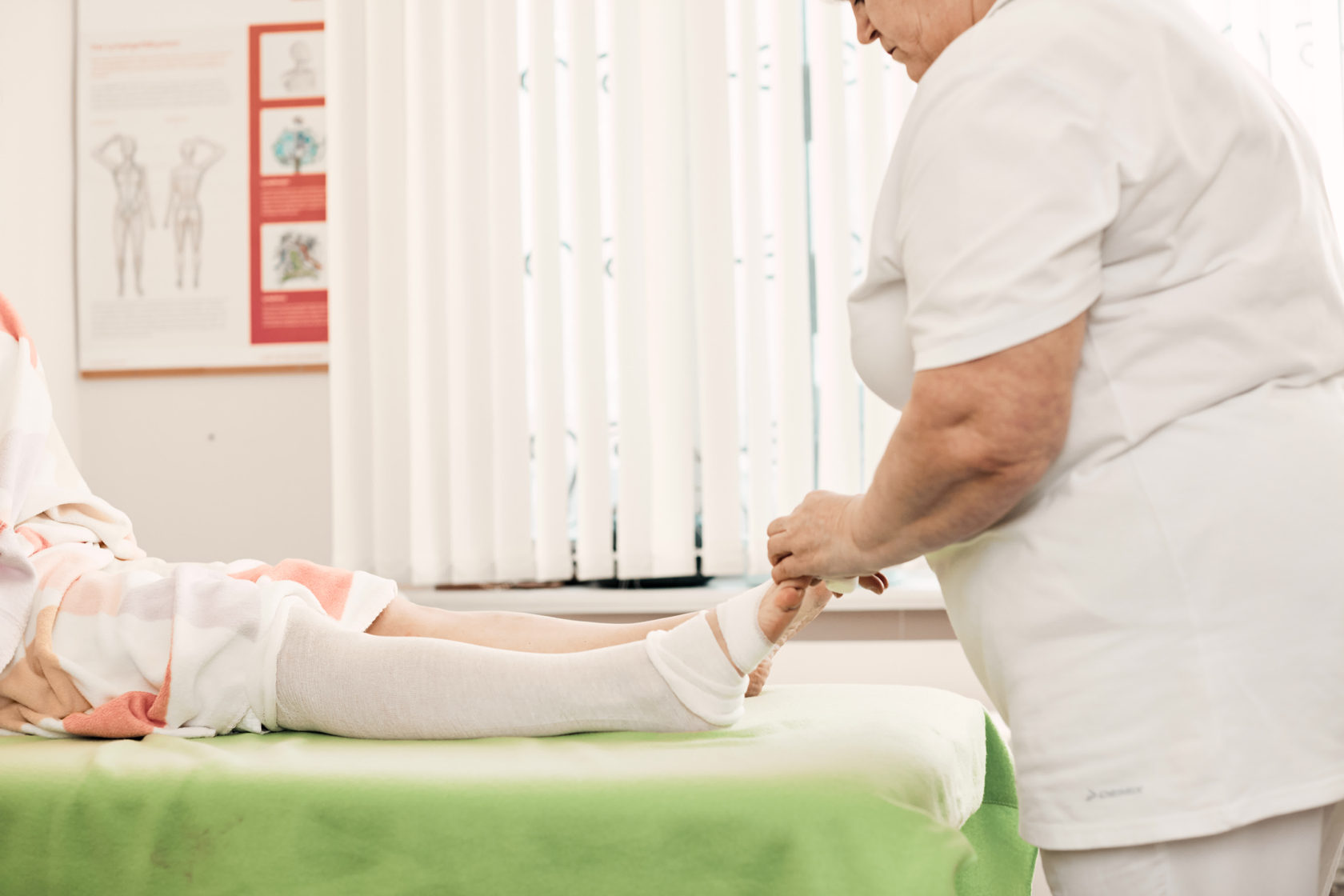 В первой они получали стандартный курс комплексной противоотёчной физической терапии (КПФТ), включающей в себя мануальный лимфодренаж (1 час), бандажирование, физические упражнения и уход за кожей. Отличие второй группы заключалось в сокращении времени ручного лимфодренажного массажа с 60 до 30 минут и дополнения переменной пневмокомпессии на аппарате lympha press plus в течение 30 минут. Оценка эффективности лечения производилась путём измерения окружности, объёма верхней конечности, оценки толщины подкожно-жировой клетчатки (при помощи УЗИ), удовлетворённости лечением по 10-бальной шкале и оценкой качества жизни по опроснику ULL-27. Результаты: в 1-й группе было достигнуто сокращение отёка на 17 %, во второй – 16,4 %, а удовлетворённость пациентов лечением в группе с аппаратной пневмокомпрессией была выше — 8,5 балла, против 7 в контрольной группе. Стоит отметить, что во второй группе наблюдались такие нежелательные реакции, как парестезии и гиперемия кожи.
В первой они получали стандартный курс комплексной противоотёчной физической терапии (КПФТ), включающей в себя мануальный лимфодренаж (1 час), бандажирование, физические упражнения и уход за кожей. Отличие второй группы заключалось в сокращении времени ручного лимфодренажного массажа с 60 до 30 минут и дополнения переменной пневмокомпессии на аппарате lympha press plus в течение 30 минут. Оценка эффективности лечения производилась путём измерения окружности, объёма верхней конечности, оценки толщины подкожно-жировой клетчатки (при помощи УЗИ), удовлетворённости лечением по 10-бальной шкале и оценкой качества жизни по опроснику ULL-27. Результаты: в 1-й группе было достигнуто сокращение отёка на 17 %, во второй – 16,4 %, а удовлетворённость пациентов лечением в группе с аппаратной пневмокомпрессией была выше — 8,5 балла, против 7 в контрольной группе. Стоит отметить, что во второй группе наблюдались такие нежелательные реакции, как парестезии и гиперемия кожи.
Олег Эдуардович Фатуев, к. м.н., главный врач ГБ №40 (Москва), хирург, онколог обратился к тематике «Возможности флюоресцентной лимфографии в выявлении и профилактики лимфореи».
м.н., главный врач ГБ №40 (Москва), хирург, онколог обратился к тематике «Возможности флюоресцентной лимфографии в выявлении и профилактики лимфореи».
Докладывает к.м.н Фатуев О.Э.
Олег Эдуардович представил результаты исследования, на основе лечения 620 онкологических пациентов с 2006 по 2015 годы в онкохирургических отделениях МУЗ ГКБ № 40 ДЗМ г. Москва. Исследование привело к следующим результатам:
1) доказана возможность использование «Флуоресцеина Новартис» для интраоперационной визуализации лимфатических сосудов и мест лимфоистечения с целью профилактики и лечения послеоперационной лимфореи;
2) разработана и морфологически обоснована методика фотодиначеской терапии;
3) предлагаемые методики позволили снизить объём лимфопотери в 4,7 раза и полностью излечивать пациентов с длительной лимфореей;
4) комплексная профилактика и лечение послеоперационной лимфореи позволяет уменьшить её длительность на 4,9 дня, тем самым сократить пребывание пациента в стационаре на 2,7 и на 7,2 суток на амбулаторном этапе.
Надежда Юрьевна Мушникова, хирург, к.м.н. (ГКБ №40, Москва) продолжила тематику интраоперационной флюоресцентной лимфографии.
Докладывает к.м.н Мушникова Н.Ю.
Накоплению флюоресцирующего вещества в опухоли способствует локальный лимфостаз (застой лимфы), эта особенность может использоваться для улучшения выявления, а следственно и лечения опухолевых заболеваний.
Мария Владимировна Ермощенкова, к.м.н., онколог, реконструктивно-пластический хирург МНИОИ им. Герцена (Москва) представила собственный опыт применения водоструйной липосакции у пациентов с вторичной лимфедемой 2 стадии по М. Фёльди.
Докладывает к.м.н., онколог Ермощенкова М.В.
Айгиз Камилиевич Фейсханов, сосудистый хирург, лимфолог центра Терра Вита (Казань) в своём докладе на тему «Комплексная физическая противоотечная терапия в лечении 3 стадии лимфедемы и ее осложнений.
Докладывает лимфолог Фейсханов А.
 К. (Казань)
К. (Казань)
Он поделился опытом успешного лечения пациентов с запущенными случаями лимфедемы (развившегося элефантиаза). Секрет успеха в использовании доказавшей свою эффективность КПФТ, индивидуальных программ реабилитации для каждого пациента.
Туяна Саяповна Будожапова (Москва), и.о. главного врача НПЦ ЛИМФА, Член Ассоциации Лимфологов России представила очень интересное сообщение на тему «Лечение гигантской лимфедемы руки после мастэктомии».
Докладывает лимфолог Будожапова Т.С. (Москва)
Заболеваемость раком молочной железы за последнее десятилетие выросла на треть. Кумулятивная частота развития лимфедемы после оперативного лечения данной патологии за 10 — ти летний период наблюдения превышает 40 %. Туяна Саяповна представила результаты лечения наиболее сложных клинических случаев. Это пациентки с 3-й стадией заболевания, которым как единственный выход была предложена ампутация верхней конечности. В центре «Лимфа» эти пациенты получали комплексную физическую противоотёчную терапию. Снижение лимфоотёка зафиксировано у всех больных, из них радикальное уменьшение объёма (на 75-100 %) было достигнуто более чем у 90 %. Таким образом методика комплексной физической противоотёчной терапии в очередной раз подтвердила свою эффективность и безопасность даже в тяжёлых клинических ситуациях, позволив добиться стойкой ремиссии заболевания.
Снижение лимфоотёка зафиксировано у всех больных, из них радикальное уменьшение объёма (на 75-100 %) было достигнуто более чем у 90 %. Таким образом методика комплексной физической противоотёчной терапии в очередной раз подтвердила свою эффективность и безопасность даже в тяжёлых клинических ситуациях, позволив добиться стойкой ремиссии заболевания.
Докладывает Мельников В.В.
Доклад доктора В.В. Мельникова (Москва) был посвящён возможностям эндолимфатического, лимфотропного введения антибиотиков в комплексном лечении гнойно-септических осложнений у больных с различными видами парентеральной наркомании. У данных пациентов региональная лимфотропная антибиотикотерапия может рассматриваться, как альтернатива длительной системной антибактериальной терапии.
Александра Вадимовна Ровная (Москва), врач реабилитолог, лимфолог, преподаватель курса Limpha Training представила доклад на тему «Ожирение, липидема, лимфедема – в чём разница (и взаимосвязь)?». Особенностью данных патологий является то, что нередко их не отличают друг от друга даже практикующие врачи, что ведёт к неверному выбору тактики лечения. Александра Вадимовна поведала о патогенетических, клинических особенностях каждого из этих заболеваний, представила алгоритм их дифференциальной диагностики, осветила подходы к лечению.
Особенностью данных патологий является то, что нередко их не отличают друг от друга даже практикующие врачи, что ведёт к неверному выбору тактики лечения. Александра Вадимовна поведала о патогенетических, клинических особенностях каждого из этих заболеваний, представила алгоритм их дифференциальной диагностики, осветила подходы к лечению.
Екатерина Юрьевна Чиж, сосудистый хирург, лимфолог (Москва) выступила с двумя сообщениями.
Докладывает лимфолог Чиж Е.Ю.
Первая лекция была посвящена противопоказаниям к проведению компрессионной терапии отечного синдрома конечностей. Вторую часть сообщения Екатерина Юрьевна посвятила опыту использования, преимуществам австралийской системы Мобидерм в комплексном лечении лимфедемы.
Нимаев Вадим Валерьевич, лимфолог, д.м.н., руководитель лабораторией оперативной лимфологии и лимфодезинтоксикации НИИ клинической и экспериментальной лимфологии (г. Новосибирск) представил результаты изучения генома пациентов с первичной наследственной лимфедемой.
Докладывает д.м.н. Нимаев В.В. (Новосибирск)
Данное исследование позволяет получить дополнительную информацию о природе заболевания, что в перспективе может помочь разрабатывать новые средства для адресного лечения и профилактики этой патологии. Во втором сообщении Вадим Валерьевич представил разрабатываемую единую базу данных – Российский регистр больных с лимфедемой и лимфатическими мальформациями.
Марина Юрьевна Демехова, хирург-флеболог сети медицинских центров REACLINIC в своём сообщении раскрыла тему «Проблема унификации диагноза и статистической обработки данных врачами-лимфологами».
Хирург-флеболог, лимфолог Демехова М.Ю. (Санкт-Петербург)
Оксана Сергеевна Курочкина, к.м.н., реконструктивный хирург, НИИ микрохирургии (Томск) поведала о возможностях микрохирургии в лечении лимфедемы. В своём докладе Оксана Сергеевна поделилась результатами работы под руководством профессора Владимира Фёдоровича Байтингера, пионера супермикрохирургии лимфатической системы в России.
Докладывает к.м.н. Курочкина О.С. (Томск)
Методика наложения лимфо-венулярных анастомозов уже доказала свою эффективность в клинической практике и является одним из перспективных направлений в хирургии лимфатической системы.
В завершение мероприятия состоялся круглый стол с обсуждением актуальных задач лимфологии, были подведены итоги VI-го Съезда лимфологов, представлен президент Ассоциации лимфологов России.
Как победить лимфедему? | ОБЩЕСТВЕННАЯ ОРГАНИЗАЦИЯ БОЛЬНЫХ С ОНКОЛОГИЧЕСКИМИ ЗАБОЛЕВАНИЯМИ
Сегодня хочется начать со слов Ивана Геннадьевича Макарова, врача-лимфолога, точнее, со Вступления в его книгу «Как победить лимфедему?»
«На данный момент в России сложилась тяжелая ситуация с диагностикой и лечением такого заболевания, как лимфедема. В медицинских вузах об этом заболевании не говорят, а о лимфатической системе практически не упоминают. Естественно, что из-за этого врачи ничего не знают о лимфатических отеках и их лечении. Чаще всего путь, который приходится проходить пациенту с жалобами на отек руки или ноги, до постановки правильного диагноза следующий: терапевт (педиатр) – хирург или ортопед – сосудистый хирург. Как правило, еще онкологи могут поставить диагноз лимфостаз своим пациентам, т. к. часто сталкиваются с таким осложнением противоопухолевого лечения. Весь этот путь занимает много времени, а отек все увеличивается. Итак, диагноз поставлен. Что дальше? А дальше врач говорит, что с этим надо жить, что дальше будет только хуже… Что надо носить компрессионный трикотаж (гольфы, чулки или рукав с перчаткой) и пить препараты Флебодиа или Детралекс… Предлагает купить аппарат для пневмомассажа (лимфопресс) или пройти курс пневмокомпрессии на базе лечебного учреждения… На этом все. Состояние постепенно ухудшается, но врачи не говорят ничего нового. Говорят – ТЕРПИ.
Чаще всего путь, который приходится проходить пациенту с жалобами на отек руки или ноги, до постановки правильного диагноза следующий: терапевт (педиатр) – хирург или ортопед – сосудистый хирург. Как правило, еще онкологи могут поставить диагноз лимфостаз своим пациентам, т. к. часто сталкиваются с таким осложнением противоопухолевого лечения. Весь этот путь занимает много времени, а отек все увеличивается. Итак, диагноз поставлен. Что дальше? А дальше врач говорит, что с этим надо жить, что дальше будет только хуже… Что надо носить компрессионный трикотаж (гольфы, чулки или рукав с перчаткой) и пить препараты Флебодиа или Детралекс… Предлагает купить аппарат для пневмомассажа (лимфопресс) или пройти курс пневмокомпрессии на базе лечебного учреждения… На этом все. Состояние постепенно ухудшается, но врачи не говорят ничего нового. Говорят – ТЕРПИ.
ЗНАКОМАЯ СИТУАЦИЯ??? А что дальше? Если терпеть, то начинаются необратимые изменения кожи и подкожной жировой клетчатки, появляются рожистые воспаления, начинается истечение лимфы, грибковые заболевания, бородавки и папилломы… Становится все хуже и хуже…
СТОП! ТАК НЕЛЬЗЯ!
ЭТО НЕ ДОЛЖНО ПРОДОЛЖАТЬСЯ!!!»
К сожалению, это так.
Онкология 21 века шагнула огромными шагами вперед как в диагностике, так и в лечении онкологических заболеваний, в том числе и по поводу рака молочной железы, особенно на ранних стадиях; проводятся сохранные операции, увеличилась продолжительность жизни с заболеванием, но до сих пор нет реабилитации, особенно нужна медицинская реабилитация.
Вызывает тревогу то, что качество жизни не улучшается у тех женщин, у которых развивается такое осложнение, как лимфатический отек руки после лечения. При этом следует знать, что не врачи виноваты в развитии осложнений, а таковы требования проводимой операции (чаще всего приходится удалять лимфатические узлы) , а также лучевая терапия, которая делается по жизненным показаниям. У одних отек появляется вскоре после операции, у других- через несколько или даже много лет.
Наша беда состоит в том, что всем после лечения нужна профилактика лимфедемы, и об этом должны знать все пациентки от своих врачей, но все как в вакууме. А ведь в мире существуют разработанные методики возможного предупреждения отека, а главное методы достаточно эффективного лечения.
Коллективу КРОО «Вита» удалось пригласить в Калининград специалиста, который знает проблему и действительно помогает людям.
МАКАРОВ Иван Геннадьевич, врач-лимфолог. Руководитель медицинского и образовательного направления в НПЦ ЛИМФА. Член Ассоциации Лимфологов России. Автор методических рекомендация для врачей и пациентов, Главный редактор научно-популярного журнала о лимфологии — «ЛИМФА».и автор книги «Как победить лимфедему?», создатель Школы пациентов по этой проблеме. Это была наша вторая встреча с доктором Макаровым, первая, короткая, в 2018 году.
Сегодня на Школу пациентов по проблеме лимфедемы из «Виты» пришли даже те, кто в последние годы не приходил на разные занятия, многие из них, имея лимфатический отек, пытались справляться сами, другим очень помогает проводимая еженедельно ЛФК.
30 ноября. Многочасовая работа: теоретическая с утра, а после обеда два часа мастер-класс.
Следует сказать, что таких учителей должно быть больше: четко, ясно, доходчиво, популярно, но научно, все- с точки зрения доказательной медицины. Огромное количество вопросов, в том числе личных. Все получили ответы.
Огромное количество вопросов, в том числе личных. Все получили ответы.
С собой из Москвы Иван Геннадьевич привез и учебные пособия, которые достались всем, а также свою книгу, ее второе издание, в том числе для нашей библиотеки.
А главное, оставлены сайт и разнообразные контакты, благодаря которым можно получить не только ответы на вопросы, но и помощь по своим проблемам
Расстались со словами благодарности лектору и с надеждой на следующую встречу.
Запись к врачу в клинику по адресу ул. академика анохина, 4, корп. 3, москва
Все клиники в Москве
Запись к врачу по телефону в клинику — Лимфа по адресу ул. Академика Анохина, 4, корп. 3, Москва
Запомни телефон:- 8 (800) 333-39-61
- 8 (800) 333-32-17
- +7 (495) 646-17-86
Открыто. Местное время 11:14
| Пн | Вт | Ср | Чт | Пт | Сб | Вс |
|---|---|---|---|---|---|---|
9:00 — 18:00 | 9:00 — 18:00 | 9:00 — 18:00 | 9:00 — 18:00 | 9:00 — 18:00 | — | — |
Голосов: 17 чел. Рейтинг: 3.8 из 5.
Рейтинг: 3.8 из 5.
Каким образом вы записываетесь к врачу? (Кол-во голосов: 13972)
Через интернет
По телефону
Лично в клинике
Я не болею
Чтобы проголосовать, кликните на нужный вариант ответа.РезультатыЛимфа
Рейтинг: 3.8 17 оценок
Записываясь на прием к врачу в клинику «Лимфа» обратите внимание на особенности:
выезд врача на домДа
Wi-FiДа
оплата картойДа
анонимное медицинское обследованиеДа
для детейДа
форма собственностичастная
Рабочее время в которое можно записаться на прием к врачу Пн-Пт с 09:00 до 18:00
Лимфа находится по адресу:
ул. Академика Анохина, 4, корп. 3, Москва
Интересно: Как записаться на прием к врачу через портал «Госуслуги»
О компании
Медицинская реабилитация Лимфа — медицинское учреждение, располагающее новейшим медицинским оборудованием опытным штатом сотрудников. Время приема заведения — пн-пт 9:00–18:00.
Дешевые услуги заведения, точный подход к лечению больного — малая часть того, что популяризует клинику в Москве.
На нашем портале Meddoclab.ruможно записаться online на приемв учреждение «Медицинская реабилитация Лимфа» , а еще узнать стоимость на услуги учреждения, посмотреть список предоставляемых услуг. Сделать запись в для медицинской реабилитации можно24 часа в сутки благодаря нашему интернет-порталу.
По выше приведенным номерам телефонов задавайте интересующие вас вопросы, консультируйтесь у представителей мед учреждения о насущных проблемах.
Продуманный и личный подход к делу — девиз компании «Медицинская реабилитация Лимфа». Приходите к нам по адресу: Россия, Москва, улица Академика Анохина, 4, корп. 3.
Заполняйте форму записи на прием к врачу к нам для медицинской реабилитации,мы с радостью Вас примем!
Фото объекта
Все клиники в Москве
Официальный сайт: Лимфа
Построить маршрут по карте до объекта медцентр, клиника, медицинская реабилитация, либо до ближайших объектов:
ул. Мичуринский Проспект, Олимпийская Деревня, 16, Москва
Мичуринский Проспект, Олимпийская Деревня, 16, Москва
ул. Мичуринский Проспект, Олимпийская Деревня, 16, корп. 1, Москва
ул. Мичуринский Проспект, Олимпийская Деревня, 16, корп. 1, Москва
ул. Мичуринский Проспект, Олимпийская Деревня, 16, корп. 1, Москва
Мичуринский Проспект, Олимпийская Деревня, 16 к1
ООО «НПЦ «ЛИМФА», Москва ИНН 9729014512, ОГРН 1167746608655
Уплаченные налоги и сборы
Сведения об уплаченных ООО «НПЦ «ЛИМФА» суммах налогов, сборов и страховых взносов (кроме налогов на ввоз
товаров в ЕврАЗЭС) по состоянию на 2019-12-31 г.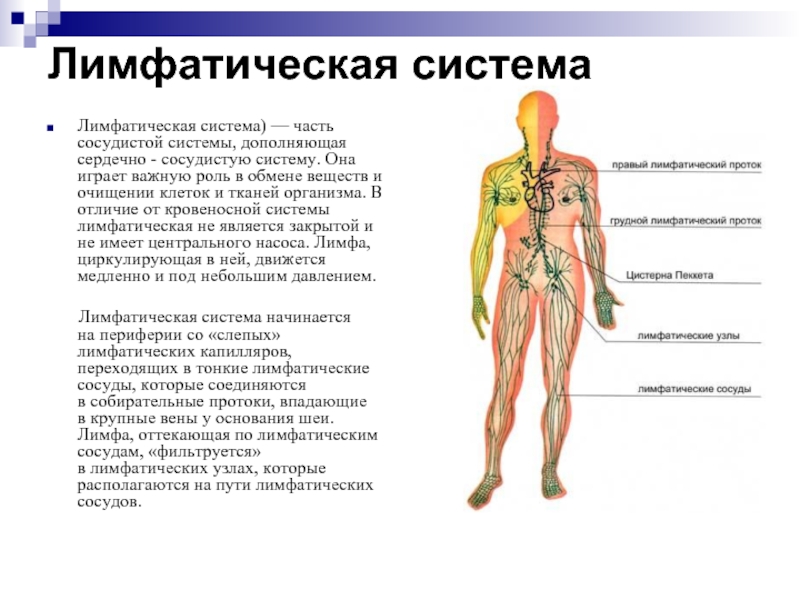
Страховые взносы на обязательное медицинское страхование работающего населения, зачисляемые в бюджет Федерального фонда обязательного медицинского страхования
56 355,00
Страховые и другие взносы на обязательное пенсионное страхование, зачисляемые в Пенсионный фонд Российской Федерации
243 100,00
Налог, взимаемый в связи с применением упрощенной системы налогообложения
204 659,00
Страховые взносы на обязательное социальное страхование на случай временной нетрудоспособности и в связи с материнством
32 045,00
Налог на прибыль
—
Стадии рака носоглотки
После того, как кому-то поставили диагноз рак носоглотки
(NPC), врачи попытаются выяснить, распространился ли он, и если да, то как далеко. Этот процесс называется staging . Сцена
рака описывает, сколько рака находится в организме. Он используется, чтобы узнать, насколько серьезен рак и как его лучше лечить. Врачи также используют стадию рака, когда говорят о статистике выживаемости.
Этот процесс называется staging . Сцена
рака описывает, сколько рака находится в организме. Он используется, чтобы узнать, насколько серьезен рак и как его лучше лечить. Врачи также используют стадию рака, когда говорят о статистике выживаемости.
Самая ранняя стадия NPC — стадия 0, также известная как карцинома in situ (CIS).Остальные стадии варьируются от I (1) до IV (4). Некоторые этапы разделены заглавными буквами (A, B и т. Д.). Как правило, чем меньше число, тем меньше распространился рак. Более высокое число, например стадия IV, означает, что рак распространился сильнее. А внутри стадии более ранняя буква означает более низкую стадию. Несмотря на то, что каждый человек сталкивается с раком уникален, раковые заболевания на одинаковых стадиях, как правило, имеют схожие взгляды и часто лечатся одинаково.
Как определяется этап?
Система стадирования, наиболее часто используемая для NPC, — это система Американского объединенного комитета по раку (AJCC) TNM , которая основана на 3 ключевых элементах информации:
- Размер основной опухоли (T): Как далеко опухоль разрослась до близлежащих структур?
- Распространяется на близлежащие лимфатические узлы (N): Распространяется ли рак на близлежащие лимфатические узлы в области шеи? Если да, то насколько они велики?
- Распространение ( метастазов ) на отдаленные участки (M): Распространяется ли рак на отдаленные части тела? (Наиболее частые места распространения — легкие, печень, кости или лимфатические узлы в отдаленных частях тела.
 )
)
Эти категории в основном основаны на результатах любых проведенных обследований, биопсий и визуализационных тестов (описанных в разделе «Как диагностируется рак носоглотки?»). Цифры или буквы после T, N и M предоставляют более подробную информацию о каждом из этих факторов.
После определения категорий T, N и M рака эта информация объединяется в процессе, называемом группировка стадий , чтобы назначить общую стадию. Подробнее об этом см. Стадия рака.
Описанная ниже система является самой последней системой AJCC для NPC, действующей в январе 2018 года.
Постановка NPC может быть сложной. Если у вас есть вопросы о стадии рака и о том, что это может значить для вас, попросите врача объяснить вам это так, как вы понимаете.
Стадии рака носоглотки
AJCC s tage | Группировка стадий | Описание этапа * |
0 | Tis | Опухоль находится только в верхнем слое клеток, выстилающих внутреннюю часть носоглотки, и не выросла глубже (Tis). Рак не распространился на близлежащие лимфатические узлы (N0) или отдаленные части тела (M0). |
I | T1 | Опухоль в носоглотке. Он также мог прорасти в ротоглотку (часть глотки в задней части рта) и / или в полость носа, но не дальше (T1). Рак не распространился на близлежащие лимфатические узлы (N0) или отдаленные части тела (M0). |
II | T1 (или T0) | Опухоль в носоглотке. Он также мог прорасти в ротоглотку (часть глотки за ртом) и / или носовую полость, но не дальше (T1). ИЛИ, в носоглотке опухоли не обнаружено, но рак обнаружен в лимфатических узлах на шее и является положительным по вирусу Эпштейна-Барра (EBV), что делает его очень вероятным NPC (T0). Рак распространился на 1 или несколько лимфатических узлов на одной стороне шеи или на лимфатические узлы за горлом. |
ИЛИ | ||
T2 | Опухоль прорастает в ткани левой или правой стороны верхней части глотки, но не в кость (T2). Рак не распространился на близлежащие лимфатические узлы (N0). ИЛИ, он распространился на 1 или несколько лимфатических узлов на одной стороне шеи, или он распространился на лимфатические узлы за горлом. В любом случае лимфатический узел не превышает 6 см в поперечнике (N1). Рак не распространился на отдаленные части тела (M0). | |
III | T1 (или T0) | Опухоль в носоглотке.Он также мог прорасти в ротоглотку (часть глотки за ртом) и / или носовую полость, но не дальше (T1). Рак распространился на лимфатические узлы с обеих сторон шеи, ни один из которых не превышает 6 см в поперечнике (N2). Рак не распространился на отдаленные части тела (M0). |
ИЛИ | ||
T2 | Опухоль прорастает в ткани левой или правой стороны верхней части глотки, но не в кость (T2).Рак распространился на лимфатические узлы по обе стороны шеи, ни один из которых не превышает 6 см в поперечнике (N2). Рак не распространился на отдаленные части тела (M0). | |
ИЛИ | ||
T3 | Опухоль прорастает в пазухи и / или близлежащие кости (T3). Рак не распространился на отдаленные части тела (M0). | |
IVA | T4 | Опухоль прорастает в череп и / или черепные нервы, гипофаринкс (нижнюю часть глотки), главную слюнную железу или глаз или его близлежащие ткани (T4). Рак мог распространиться или не распространиться на близлежащие лимфатические узлы на шее или за горлом, но ни один из них не превышает 6 см в поперечнике (от N0 до N2).Рак не распространился на отдаленные части тела (M0). |
ИЛИ | ||
Любой T | Опухоль могла или не могла прорасти в структуры за пределами носоглотки (любой Т). Рак не распространился на отдаленные части тела (M0). | |
IVB | Любой T | Опухоль могла или не могла прорасти в структуры за пределами носоглотки (любой Т). Рак мог или не мог распространиться на близлежащие лимфатические узлы (любой N). Рак распространился на отдаленные части тела (M1). |
* Следующие дополнительные категории не указаны в таблице выше:
- TX: Основная опухоль не может быть оценена из-за отсутствия информации.
- NX: близлежащие лимфатические узлы не могут быть оценены из-за отсутствия информации.
Рак носоглотки: стадии и степени
НА ЭТОЙ СТРАНИЦЕ: Вы узнаете, как врачи описывают рост или распространение рака. Это называется этапом. Используйте меню для просмотра других страниц.
Это называется этапом. Используйте меню для просмотра других страниц.
Стадия — это способ описания того, где находится рак, если или где он распространился, а также влияет ли он на другие части тела.
Врачи используют диагностические тесты, чтобы определить стадию рака, поэтому определение стадии может быть неполным, пока не будут завершены все тесты.Знание стадии помогает врачу решить, какое лечение порекомендовать, и может помочь предсказать прогноз пациента, который является шансом на выздоровление. Существуют разные описания стадий для разных типов рака.
Промежуточная система TNM
Одним из инструментов, который врачи используют для описания стадии, является система TNM. Врачи используют результаты диагностических тестов и сканирования, чтобы ответить на следующие вопросы:
Опухоль (T): Насколько велика первичная опухоль? Где он находится?
Узел (N): Распространяется ли опухоль на лимфатические узлы? Если да, то где и сколько?
Метастазы (M): Распространился ли рак на другие части тела? Если да, то где и сколько?
Результаты объединяются, чтобы определить стадию рака для каждого человека.
Существует 5 стадий NPC: стадия 0 (нулевая) и стадии с I по IV (с 1 по 4). Этап представляет собой общий способ описания рака, поэтому врачи могут работать вместе, чтобы спланировать наилучшее лечение.
Недавно врачи обнаружили, что определение наличия вируса Эпштейна-Барра (EBV; см. Факторы риска и диагностика) может быть полезным для определения стадии.
Вот более подробная информация о каждой части системы TNM для NPC.
Опухоль (T)
В системе TNM буква «Т» плюс буква или цифра (от 0 до 4) используется для описания размера и местоположения опухоли.Стадия также может быть разделена на более мелкие группы, которые помогают описать опухоль еще более подробно. Информация о конкретной стадии опухоли приведена ниже.
TX: Первичная опухоль не может быть оценена.
Tis: Здесь описывается стадия, называемая карциномой (рак) in situ. Это очень ранний рак, при котором раковые клетки обнаруживаются только в 1 слое ткани.
T0 (T плюс ноль): Признаков опухоли не обнаружено, но на шее есть лимфатические узлы, положительные на ВЭБ.
T1: Опухоль не распространилась за пределы носоглотки. Или опухоль прорастает в ротоглотку и / или носовую полость, но не затрагивает области вокруг глотки.
T2: Опухоль распространяется на мягкие ткани среднего глотки.
T3: Опухоль распространяется на костную структуру или в область за носом.
T4: Опухоль распространяется внутри головы в область головного мозга или в нижнюю часть глотки.
Узел (N)
Буква «N» в промежуточной системе TNM предназначена для лимфатических узлов. Эти маленькие бобовидные органы помогают бороться с инфекцией. Лимфатические узлы рядом с местом начала рака называются региональными лимфатическими узлами. Лимфатические узлы в других частях тела называются удаленными лимфатическими узлами.
У людей с NPC врачи исследуют лимфатические узлы в области треугольной формы, образованной 3 точками: там, где шея соединяется с плечом, где ключица соединяется с концом плеча и где передняя половина ключицы встречается с основанием плеча. шея.
шея.
NX: Невозможно оценить регионарные лимфатические узлы.
N0 (N плюс ноль): Нет свидетельств рака регионарных лимфатических узлов.
N1: Рак распространился на лимфатические узлы выше треугольной области, описанной выше. Лимфатические узлы находятся на той же стороне шеи, что и первичная опухоль. Рак, обнаруживаемый в лимфатических узлах, составляет 6 сантиметров (см) или меньше. Сантиметр примерно равен ширине стандартной ручки или карандаша.
N2: Рак распространился на лимфатические узлы по обеим сторонам шеи, выше треугольной области, но рак составляет 6 см или меньше.
N3: Рак, обнаруженный в лимфатических узлах, превышает 6 см и / или обнаруживается в лимфатических узлах, расположенных в треугольнике.
Метастазы (M)
Буква «M» в системе TNM описывает, распространился ли рак на другие части тела, что называется отдаленными метастазами.
M0 (M плюс ноль): Рак не распространился на другие части тела.
M1: Рак распространился на другие части тела.
Группа стадий рака
Врачи определяют стадию рака, комбинируя классификации T, N и M.
Стадия 0: Карцинома in situ без распространения на лимфатические узлы и без отдаленных метастазов (Tis, N0, M0).
Стадия I: Небольшая опухоль без распространения на лимфатические узлы и без отдаленных метастазов (T1, N0, M0).
Стадия II: Имеются данные о ВЭБ в лимфатических узлах шеи или опухоли, обнаруженной только в носоглотке, которая распространилась на лимфатические узлы, но без метастазов (T0 или T1, N1, M0). Эта стадия также может описывать опухоль, которая распространилась за пределы носоглотки, но не распространилась на лимфатические узлы или отдаленные части тела (T2, N0, M0). Он также может описывать опухоль, которая распространилась на лимфатические узлы, но не распространилась где-либо еще (T2, N1, M0).
Стадия III: Неинвазивная или инвазивная опухоль, которая распространилась на лимфатические узлы с обеих сторон шеи выше треугольной области, но не дала метастазов (T0, T1 или T2; N2; M0). Эта стадия также может описывать большую опухоль с поражением лимфатических узлов или без него и без метастазов (T3; N0, N1 или N2; M0).
Стадия IVA: Здесь описывается любая инвазивная опухоль без поражения лимфатических узлов или распространяющаяся только на один односторонний лимфатический узел, но без метастазов (T4, N0 или N1, M0). Он также используется для любой инвазивной опухоли с более значительным поражением лимфатических узлов, но без метастазов (T4, N2, M0). Он также описывает любую опухоль (любую T) с обширным поражением лимфатических узлов, но без метастазов (любые T, N3, M0).
Стадия IVB: Это описывает любую опухоль, когда есть доказательства отдаленного распространения (любой T, любой N, M1).
Рецидив: Рецидив рака — это рак, который вернулся после лечения. Если рак все же вернется, будет проведен еще один раунд тестов, чтобы узнать о степени рецидива. Эти тесты и сканирование часто аналогичны тем, которые проводились во время первоначального диагноза.
Если рак все же вернется, будет проведен еще один раунд тестов, чтобы узнать о степени рецидива. Эти тесты и сканирование часто аналогичны тем, которые проводились во время первоначального диагноза.
Используется с разрешения Американского колледжа хирургов, Чикаго, Иллинойс. Первоначальным и основным источником этой информации является Руководство по стадированию рака AJCC , восьмое издание (2017 г.), , опубликованное Springer International Publishing.
Информация о стадии рака поможет врачу порекомендовать конкретный план лечения. Следующий раздел в этом руководстве — Типы лечения . Используйте меню, чтобы выбрать другой раздел для чтения в этом руководстве.
Метаанализ клинических данных
Сводка результатов
Рак носоглотки (NPC) имеет высокую вероятность метастазирования в шейный узел. Результаты этого метаанализа, основанные на 13 клинических испытаниях с использованием МРТ для диагностики и определения стадии NPC, показали, что наиболее часто задействованные области шейных лимфатических узлов включают латеральные ретрофарингеальные узлы и узлы уровня II с общей вероятностью 69. 4% и 70,4% соответственно для метастазов. За этими узловыми группами первого эшелона следуют уровни III, VA и IV с вероятностями 44,9%, 26,7%, 11,2% соответственно. Определенные группы шейных лимфатических узлов, включая уровень I, уровень VI, околоушные и надключичные узлы, имеют очень низкий риск метастазирования. Важным открытием было то, что лимфатическое распространение в шейной узловой цепи от первичного NPC происходит упорядоченно. Риск метастазирования в пропускающие узлы был очень низким — 0,5% [14].
4% и 70,4% соответственно для метастазов. За этими узловыми группами первого эшелона следуют уровни III, VA и IV с вероятностями 44,9%, 26,7%, 11,2% соответственно. Определенные группы шейных лимфатических узлов, включая уровень I, уровень VI, околоушные и надключичные узлы, имеют очень низкий риск метастазирования. Важным открытием было то, что лимфатическое распространение в шейной узловой цепи от первичного NPC происходит упорядоченно. Риск метастазирования в пропускающие узлы был очень низким — 0,5% [14].
Эти данные важны для лечения NPC, особенно при определении правильных направлений лечения для окончательной лучевой терапии с использованием конформной технологии, такой как лучевая терапия с модуляцией интенсивности (IMRT).Поскольку субклиническое поражение шейных лимфатических узлов не может быть надежно обнаружено с помощью исследований изображений, включая КТ, МРТ и / или ПЭТ / КТ, правильный выбор и определение клинического целевого объема для планового облучения представляет собой серьезную проблему. Двусторонние метастазы в шейных лимфатических узлах обычно возникают на ранней стадии развития заболевания. Таким образом, облучение всей шейной лимфодренажной области было обычной практикой в лучевой терапии НПК, включая болезнь I стадии [3,28,29], с радиационными порталами, охватывающими все уровни шейных лимфатических узлов от IB до V, включая надключичные. регион [30].Несмотря на улучшение результатов с точки зрения локорегионального контроля и показателей выживаемости без болезней с помощью IMRT, [31,32] такая стратегия лечения может представлять собой чрезмерное лечение с использованием современных диагностических и терапевтических технологий. Пациенты с NPC, которые излечились от своего заболевания, могут страдать от долгосрочных осложнений лечения [5], включая ксеростомию, фиброз шеи, телеангиэктазии, дисфункцию щитовидной железы, плечевую плексопатию и вторичные злокачественные новообразования, которые могут значительно повлиять на функцию, качество жизни или продолжительность жизни.
Двусторонние метастазы в шейных лимфатических узлах обычно возникают на ранней стадии развития заболевания. Таким образом, облучение всей шейной лимфодренажной области было обычной практикой в лучевой терапии НПК, включая болезнь I стадии [3,28,29], с радиационными порталами, охватывающими все уровни шейных лимфатических узлов от IB до V, включая надключичные. регион [30].Несмотря на улучшение результатов с точки зрения локорегионального контроля и показателей выживаемости без болезней с помощью IMRT, [31,32] такая стратегия лечения может представлять собой чрезмерное лечение с использованием современных диагностических и терапевтических технологий. Пациенты с NPC, которые излечились от своего заболевания, могут страдать от долгосрочных осложнений лечения [5], включая ксеростомию, фиброз шеи, телеангиэктазии, дисфункцию щитовидной железы, плечевую плексопатию и вторичные злокачественные новообразования, которые могут значительно повлиять на функцию, качество жизни или продолжительность жизни. Хотя некоторые из этих побочных эффектов были сведены к минимуму с появлением конформной лучевой терапии, их нельзя полностью предотвратить, особенно если узловые клинические целевые объемы соседствуют с критическими структурами.
Хотя некоторые из этих побочных эффектов были сведены к минимуму с появлением конформной лучевой терапии, их нельзя полностью предотвратить, особенно если узловые клинические целевые объемы соседствуют с критическими структурами.
Эффективной стратегией снижения заболеваемости, вызванной лечением, является минимизация поля для планового облучения в не затронутой области шеи. В недавно опубликованном исследовании Lin и соавторов исключение лимфатических узлов уровня Ib и надключичной области для планового лечения в IMRT для локально-регионально распространенного NPC не уменьшало вероятность регионального контроля по сравнению с историческим контролем [33].Кроме того, в недавно опубликованном исследовании более 400 пациентов с NPC с болезнью N0, которые лечились окончательной дозой облучения только в первичном и верхнем полях шеи (уровни II, III и Va), рецидив вне поля излучения в область шеи и надключичная область IV уровня наблюдались только у одного пациента [34]. Аналогичный ретроспективный обзор 924 пациентов с NPC с болезнью N0, сравнивающих нижнюю границу лучевой терапии либо на перстневидном хряще, либо ниже перстневидного хряща, не выявил статистически значимых различий между двумя группами [14]. Использование МРТ для диагностики и определения стадии и / или более сложных стратегий лечения, включая IMRT и сопутствующую химиолучевую терапию, может сыграть существенную роль в вышеупомянутых результатах. Однако оптимальная стратегия выбора и определения субклинической региональной болезни в клиническом целевом объеме (CTV) при лечении NPC не получила должного внимания. Знания о региональном дренаже лимфатических узлов у NPC, диагностированных и поставленных в современную эпоху, особенно с помощью МРТ, ограничены, а имеющиеся в настоящее время данные обычно не полны с противоречивыми результатами.Более системное и всестороннее понимание паттернов вовлечения шейных узлов в NPC явно необходимо для правильного планирования клинических испытаний с использованием методов конформного излучения и предоставит клинические данные, изменяющие практику.
Использование МРТ для диагностики и определения стадии и / или более сложных стратегий лечения, включая IMRT и сопутствующую химиолучевую терапию, может сыграть существенную роль в вышеупомянутых результатах. Однако оптимальная стратегия выбора и определения субклинической региональной болезни в клиническом целевом объеме (CTV) при лечении NPC не получила должного внимания. Знания о региональном дренаже лимфатических узлов у NPC, диагностированных и поставленных в современную эпоху, особенно с помощью МРТ, ограничены, а имеющиеся в настоящее время данные обычно не полны с противоречивыми результатами.Более системное и всестороннее понимание паттернов вовлечения шейных узлов в NPC явно необходимо для правильного планирования клинических испытаний с использованием методов конформного излучения и предоставит клинические данные, изменяющие практику.
Хотя наши результаты представляют собой наиболее полные и убедительные данные о характере и вероятности распространения шейных лимфатических узлов при NPC, необходимо решить ряд вопросов, связанных с дизайном и анализом. Поскольку лучевая терапия в настоящее время является единственным лечебным лечением, а хирургия, включая рассечение шеи, играет ограниченную роль в первичном лечении NPC, аденопатия повсеместно диагностируется с помощью визуальных исследований.Гистологическая диагностика метастазов в шейных узлах проводится редко. Радиологический диагноз лимфаденопатии шейки матки в значительной степени основывается на критериях размера и морфологии [35], полученных на основе хирургических серий. До использования МРТ для определения стадии и диагностики NPC обычно оценивали с помощью КТ с контрастированием для оценки степени заболевания как в первичной области, так и в области шеи [36]. Большинство доступных данных о поражении шейного узла и его лечении основаны на компьютерной томографии. Однако показатели чувствительности и специфичности расширенной КТ для диагностики лимфаденопатии шейки матки составляют примерно 14–60% и 78–92% соответственно по сравнению с 29–80% и 82–92% соответственно для МРТ [35].
Поскольку лучевая терапия в настоящее время является единственным лечебным лечением, а хирургия, включая рассечение шеи, играет ограниченную роль в первичном лечении NPC, аденопатия повсеместно диагностируется с помощью визуальных исследований.Гистологическая диагностика метастазов в шейных узлах проводится редко. Радиологический диагноз лимфаденопатии шейки матки в значительной степени основывается на критериях размера и морфологии [35], полученных на основе хирургических серий. До использования МРТ для определения стадии и диагностики NPC обычно оценивали с помощью КТ с контрастированием для оценки степени заболевания как в первичной области, так и в области шеи [36]. Большинство доступных данных о поражении шейного узла и его лечении основаны на компьютерной томографии. Однако показатели чувствительности и специфичности расширенной КТ для диагностики лимфаденопатии шейки матки составляют примерно 14–60% и 78–92% соответственно по сравнению с 29–80% и 82–92% соответственно для МРТ [35].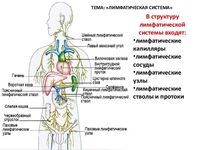 Недавно также сообщалось о преимуществах МРТ перед КТ при оценке шейных лимфатических узлов на наличие NPC [37]. Кроме того, метаанализ показал, что точность МРТ превосходит ПЭТ-КТ при оценке шейной лимфаденопатии [38]. Соответственно, обновленное издание 7 -го Классификации злокачественных опухолей TNM [39] предлагает считать МРТ стандартным методом визуализации для диагностики и определения стадии NPC.
Недавно также сообщалось о преимуществах МРТ перед КТ при оценке шейных лимфатических узлов на наличие NPC [37]. Кроме того, метаанализ показал, что точность МРТ превосходит ПЭТ-КТ при оценке шейной лимфаденопатии [38]. Соответственно, обновленное издание 7 -го Классификации злокачественных опухолей TNM [39] предлагает считать МРТ стандартным методом визуализации для диагностики и определения стадии NPC.
Кроме того, местнораспространенная опухоль носоглотки, очевидно, будет иметь более высокую вероятность метастазирования в шейные лимфатические узлы по сравнению с ранней стадией заболевания.Знание точной стадии NPC для каждого объекта исследования может дать ценную информацию о том, как узловые метастазы меняются с стадией опухоли. К сожалению, эта информация не была доступна для таких анализов.
Одной из самых больших проблем при выполнении этого метаанализа было взвешивание отдельных исследований. Дизайн исследований был весьма неоднородным — от проспективного до ретроспективного (преобладающего). Многие из них не были предназначены для изучения регионарных узловых метастазов в качестве основной конечной точки, но были включены из-за нехватки таких данных в эпоху МРТ.Таким образом, обычные критерии оценки исследований в систематических обзорах не могут быть применены к этому исследованию [40,41].
Многие из них не были предназначены для изучения регионарных узловых метастазов в качестве основной конечной точки, но были включены из-за нехватки таких данных в эпоху МРТ.Таким образом, обычные критерии оценки исследований в систематических обзорах не могут быть применены к этому исследованию [40,41].
Метаанализ клинических данных
Сводка результатов
Рак носоглотки (NPC) имеет высокую вероятность метастазирования в шейный узел. Результаты этого метаанализа, основанные на 13 клинических испытаниях с использованием МРТ для диагностики и определения стадии NPC, показали, что наиболее часто задействованные области шейных лимфатических узлов включают латеральные ретрофарингеальные узлы и узлы уровня II с общей вероятностью 69.4% и 70,4% соответственно для метастазов. За этими узловыми группами первого эшелона следуют уровни III, VA и IV с вероятностями 44,9%, 26,7%, 11,2% соответственно. Определенные группы шейных лимфатических узлов, включая уровень I, уровень VI, околоушные и надключичные узлы, имеют очень низкий риск метастазирования. Важным открытием было то, что лимфатическое распространение в шейной узловой цепи от первичного NPC происходит упорядоченно. Риск метастазирования в пропускающие узлы был очень низким — 0,5% [14].
Важным открытием было то, что лимфатическое распространение в шейной узловой цепи от первичного NPC происходит упорядоченно. Риск метастазирования в пропускающие узлы был очень низким — 0,5% [14].
Эти данные важны для лечения NPC, особенно при определении правильных направлений лечения для окончательной лучевой терапии с использованием конформной технологии, такой как лучевая терапия с модуляцией интенсивности (IMRT).Поскольку субклиническое поражение шейных лимфатических узлов не может быть надежно обнаружено с помощью исследований изображений, включая КТ, МРТ и / или ПЭТ / КТ, правильный выбор и определение клинического целевого объема для планового облучения представляет собой серьезную проблему. Двусторонние метастазы в шейных лимфатических узлах обычно возникают на ранней стадии развития заболевания. Таким образом, облучение всей шейной лимфодренажной области было обычной практикой в лучевой терапии НПК, включая болезнь I стадии [3,28,29], с радиационными порталами, охватывающими все уровни шейных лимфатических узлов от IB до V, включая надключичные. регион [30].Несмотря на улучшение результатов с точки зрения локорегионального контроля и показателей выживаемости без болезней с помощью IMRT, [31,32] такая стратегия лечения может представлять собой чрезмерное лечение с использованием современных диагностических и терапевтических технологий. Пациенты с NPC, которые излечились от своего заболевания, могут страдать от долгосрочных осложнений лечения [5], включая ксеростомию, фиброз шеи, телеангиэктазии, дисфункцию щитовидной железы, плечевую плексопатию и вторичные злокачественные новообразования, которые могут значительно повлиять на функцию, качество жизни или продолжительность жизни.Хотя некоторые из этих побочных эффектов были сведены к минимуму с появлением конформной лучевой терапии, их нельзя полностью предотвратить, особенно если узловые клинические целевые объемы соседствуют с критическими структурами.
регион [30].Несмотря на улучшение результатов с точки зрения локорегионального контроля и показателей выживаемости без болезней с помощью IMRT, [31,32] такая стратегия лечения может представлять собой чрезмерное лечение с использованием современных диагностических и терапевтических технологий. Пациенты с NPC, которые излечились от своего заболевания, могут страдать от долгосрочных осложнений лечения [5], включая ксеростомию, фиброз шеи, телеангиэктазии, дисфункцию щитовидной железы, плечевую плексопатию и вторичные злокачественные новообразования, которые могут значительно повлиять на функцию, качество жизни или продолжительность жизни.Хотя некоторые из этих побочных эффектов были сведены к минимуму с появлением конформной лучевой терапии, их нельзя полностью предотвратить, особенно если узловые клинические целевые объемы соседствуют с критическими структурами.
Эффективной стратегией снижения заболеваемости, вызванной лечением, является минимизация поля для планового облучения в не затронутой области шеи. В недавно опубликованном исследовании Lin и соавторов исключение лимфатических узлов уровня Ib и надключичной области для планового лечения в IMRT для локально-регионально распространенного NPC не уменьшало вероятность регионального контроля по сравнению с историческим контролем [33].Кроме того, в недавно опубликованном исследовании более 400 пациентов с NPC с болезнью N0, которые лечились окончательной дозой облучения только в первичном и верхнем полях шеи (уровни II, III и Va), рецидив вне поля излучения в область шеи и надключичная область IV уровня наблюдались только у одного пациента [34]. Аналогичный ретроспективный обзор 924 пациентов с NPC с болезнью N0, сравнивающих нижнюю границу лучевой терапии либо на перстневидном хряще, либо ниже перстневидного хряща, не выявил статистически значимых различий между двумя группами [14].Использование МРТ для диагностики и определения стадии и / или более сложных стратегий лечения, включая IMRT и сопутствующую химиолучевую терапию, может сыграть существенную роль в вышеупомянутых результатах.
В недавно опубликованном исследовании Lin и соавторов исключение лимфатических узлов уровня Ib и надключичной области для планового лечения в IMRT для локально-регионально распространенного NPC не уменьшало вероятность регионального контроля по сравнению с историческим контролем [33].Кроме того, в недавно опубликованном исследовании более 400 пациентов с NPC с болезнью N0, которые лечились окончательной дозой облучения только в первичном и верхнем полях шеи (уровни II, III и Va), рецидив вне поля излучения в область шеи и надключичная область IV уровня наблюдались только у одного пациента [34]. Аналогичный ретроспективный обзор 924 пациентов с NPC с болезнью N0, сравнивающих нижнюю границу лучевой терапии либо на перстневидном хряще, либо ниже перстневидного хряща, не выявил статистически значимых различий между двумя группами [14].Использование МРТ для диагностики и определения стадии и / или более сложных стратегий лечения, включая IMRT и сопутствующую химиолучевую терапию, может сыграть существенную роль в вышеупомянутых результатах. Однако оптимальная стратегия выбора и определения субклинической региональной болезни в клиническом целевом объеме (CTV) при лечении NPC не получила должного внимания. Знания о региональном дренаже лимфатических узлов у NPC, диагностированных и поставленных в современную эпоху, особенно с помощью МРТ, ограничены, а имеющиеся в настоящее время данные обычно не полны с противоречивыми результатами.Более системное и всестороннее понимание паттернов вовлечения шейных узлов в NPC явно необходимо для правильного планирования клинических испытаний с использованием методов конформного излучения и предоставит клинические данные, изменяющие практику.
Однако оптимальная стратегия выбора и определения субклинической региональной болезни в клиническом целевом объеме (CTV) при лечении NPC не получила должного внимания. Знания о региональном дренаже лимфатических узлов у NPC, диагностированных и поставленных в современную эпоху, особенно с помощью МРТ, ограничены, а имеющиеся в настоящее время данные обычно не полны с противоречивыми результатами.Более системное и всестороннее понимание паттернов вовлечения шейных узлов в NPC явно необходимо для правильного планирования клинических испытаний с использованием методов конформного излучения и предоставит клинические данные, изменяющие практику.
Хотя наши результаты представляют собой наиболее полные и убедительные данные о характере и вероятности распространения шейных лимфатических узлов при NPC, необходимо решить ряд вопросов, связанных с дизайном и анализом. Поскольку лучевая терапия в настоящее время является единственным лечебным лечением, а хирургия, включая рассечение шеи, играет ограниченную роль в первичном лечении NPC, аденопатия повсеместно диагностируется с помощью визуальных исследований. Гистологическая диагностика метастазов в шейных узлах проводится редко. Радиологический диагноз лимфаденопатии шейки матки в значительной степени основывается на критериях размера и морфологии [35], полученных на основе хирургических серий. До использования МРТ для определения стадии и диагностики NPC обычно оценивали с помощью КТ с контрастированием для оценки степени заболевания как в первичной области, так и в области шеи [36]. Большинство доступных данных о поражении шейного узла и его лечении основаны на компьютерной томографии. Однако показатели чувствительности и специфичности расширенной КТ для диагностики лимфаденопатии шейки матки составляют примерно 14–60% и 78–92% соответственно по сравнению с 29–80% и 82–92% соответственно для МРТ [35].Недавно также сообщалось о преимуществах МРТ перед КТ при оценке шейных лимфатических узлов на наличие NPC [37]. Кроме того, метаанализ показал, что точность МРТ превосходит ПЭТ-КТ при оценке шейной лимфаденопатии [38]. Соответственно, обновленное издание 7 -го Классификации злокачественных опухолей TNM [39] предлагает считать МРТ стандартным методом визуализации для диагностики и определения стадии NPC.
Гистологическая диагностика метастазов в шейных узлах проводится редко. Радиологический диагноз лимфаденопатии шейки матки в значительной степени основывается на критериях размера и морфологии [35], полученных на основе хирургических серий. До использования МРТ для определения стадии и диагностики NPC обычно оценивали с помощью КТ с контрастированием для оценки степени заболевания как в первичной области, так и в области шеи [36]. Большинство доступных данных о поражении шейного узла и его лечении основаны на компьютерной томографии. Однако показатели чувствительности и специфичности расширенной КТ для диагностики лимфаденопатии шейки матки составляют примерно 14–60% и 78–92% соответственно по сравнению с 29–80% и 82–92% соответственно для МРТ [35].Недавно также сообщалось о преимуществах МРТ перед КТ при оценке шейных лимфатических узлов на наличие NPC [37]. Кроме того, метаанализ показал, что точность МРТ превосходит ПЭТ-КТ при оценке шейной лимфаденопатии [38]. Соответственно, обновленное издание 7 -го Классификации злокачественных опухолей TNM [39] предлагает считать МРТ стандартным методом визуализации для диагностики и определения стадии NPC.
Кроме того, местнораспространенная опухоль носоглотки, очевидно, будет иметь более высокую вероятность метастазирования в шейные лимфатические узлы по сравнению с ранней стадией заболевания.Знание точной стадии NPC для каждого объекта исследования может дать ценную информацию о том, как узловые метастазы меняются с стадией опухоли. К сожалению, эта информация не была доступна для таких анализов.
Одной из самых больших проблем при выполнении этого метаанализа было взвешивание отдельных исследований. Дизайн исследований был весьма неоднородным — от проспективного до ретроспективного (преобладающего). Многие из них не были предназначены для изучения регионарных узловых метастазов в качестве основной конечной точки, но были включены из-за нехватки таких данных в эпоху МРТ.Таким образом, обычные критерии оценки исследований в систематических обзорах не могут быть применены к этому исследованию [40,41].
Исследование надзора, эпидемиологии и конечных результатов, 2006–2015 гг.
Это исследование проводилось для выявления факторов, связанных с метастазами лимфатических узлов (ЛУ) у пациентов с карциномой носоглотки (НПК), анализа характера распределения узлов и изучения прогностической ценности уровня метастазов в ЛУ для выживаемости. Мы включили 2994 пациента с первичным NPC, диагностированным в период с 2006 по 2015 год, с информацией из базы данных эпиднадзора, эпидемиологии и конечных результатов (SEER).Демографические и клинико-патологические характеристики пациентов сравнивались в соответствии со статусом LN с использованием критериев хи-квадрат. 5-летняя общая выживаемость (OS) и выживаемость при раке (CSS) рассчитывались по методу Каплана-Мейера, а различия оценивались с помощью лог-ранговых тестов. Для оценки независимых факторов риска OS и CSS использовались многомерные модели пропорциональных рисков Кокса. Логистическая регрессия использовалась для оценки риска отдаленных метастазов каждой категории метастазов в ЛУ. 695 пациентов находились на стадии N0 и 2299 пациентов с метастазами в LN (классифицируются как стадии N1, N2 или N3). Общая частота метастазов в ЛУ составила 76,8%. Пол и стадия Т не были связаны с метастазами в ЛУ. У пожилых пациентов были значительно худшие 5-летние ОС и CSS, чем у более молодых пациентов. По гистологическому типу ороговевшая плоскоклеточная карцинома имела самые низкие 5-летнюю ОС и КСС — 48,2% и 53,8% соответственно. Наиболее частым уровнем поражения узлов был II (65,9%), за ним следовали III (29,1%), V (25,6%), I (17,6%), IV (15,7%) и заглотка (13,5%). Частота пропуска метастазов составила 5,7% (130/2299).Пациенты с метастазами только второго уровня (классифицируются как уровень 2) были наиболее частой категорией, составляя 30%. По сравнению с уровнем 2, пациенты только с уровнем I (классифицированным как уровень 1) имели OR 2,101 (95% ДИ: 1,090–4,047) для отдаленных метастазов, пациенты с одновременным уровнем II, III, IV и V (классифицируются как уровни 2345) имели самый высокий OR 4,064 (95% ДИ: 2,155–7,666) для отдаленных метастазов, а уровень 24 имел OR 3,003 (95% ДИ: 1,074–8,395) для отдаленных метастазов.
Общая частота метастазов в ЛУ составила 76,8%. Пол и стадия Т не были связаны с метастазами в ЛУ. У пожилых пациентов были значительно худшие 5-летние ОС и CSS, чем у более молодых пациентов. По гистологическому типу ороговевшая плоскоклеточная карцинома имела самые низкие 5-летнюю ОС и КСС — 48,2% и 53,8% соответственно. Наиболее частым уровнем поражения узлов был II (65,9%), за ним следовали III (29,1%), V (25,6%), I (17,6%), IV (15,7%) и заглотка (13,5%). Частота пропуска метастазов составила 5,7% (130/2299).Пациенты с метастазами только второго уровня (классифицируются как уровень 2) были наиболее частой категорией, составляя 30%. По сравнению с уровнем 2, пациенты только с уровнем I (классифицированным как уровень 1) имели OR 2,101 (95% ДИ: 1,090–4,047) для отдаленных метастазов, пациенты с одновременным уровнем II, III, IV и V (классифицируются как уровни 2345) имели самый высокий OR 4,064 (95% ДИ: 2,155–7,666) для отдаленных метастазов, а уровень 24 имел OR 3,003 (95% ДИ: 1,074–8,395) для отдаленных метастазов. В анализе выживаемости уровни 235 имели значимый HR 1.708 (95% ДИ: 1,089–2,678) для CSS по сравнению с уровнем 2 после поправки на возраст, пол, расу, гистологию, стадию TNM (опухоль, узел и метастаз) и лечение.
В анализе выживаемости уровни 235 имели значимый HR 1.708 (95% ДИ: 1,089–2,678) для CSS по сравнению с уровнем 2 после поправки на возраст, пол, расу, гистологию, стадию TNM (опухоль, узел и метастаз) и лечение.
1. Введение
Карцинома носоглотки (NPC) — редкий рак, возникающий из эпителия носоглотки. Во всем мире уровень заболеваемости NPC составляет менее 1 случая на 100 000 человеко-лет [1]; однако в эндемичных регионах, таких как Юго-Восточная Азия и Северная Африка, он составляет от 20 до 40 на 100 000 человек [2, 3].
Среди видов рака головы и шеи, NPC имеет самый высокий преобладание метастазов в регионарные лимфатические узлы (ЛУ) [4].Из-за обширной сети лимфатических капилляров подслизистой оболочки лопаток в регионе частота метастазов ЛУ достигает 70%. С развитием передовых методов визуализации, таких как магнитно-резонансная томография (МРТ) и позитронно-эмиссионная томография / компьютерная томография (ПЭТ / КТ), метастазы в ЛУ обнаруживаются более легко и точно. Паттерны метастазов в LN являются значимыми предикторами отдаленных метастазов и имеют прогностическое влияние на общую выживаемость и выживаемость без отдаленных метастазов [5, 6]. Насколько нам известно, большинство исследований сосредоточено на вероятностях распределения на каждом уровне [7–9]; однако имеется ограниченная информация о прогностической ценности категории метастазов ЛУ для отдаленных метастазов и выживаемости.
Паттерны метастазов в LN являются значимыми предикторами отдаленных метастазов и имеют прогностическое влияние на общую выживаемость и выживаемость без отдаленных метастазов [5, 6]. Насколько нам известно, большинство исследований сосредоточено на вероятностях распределения на каждом уровне [7–9]; однако имеется ограниченная информация о прогностической ценности категории метастазов ЛУ для отдаленных метастазов и выживаемости.
Лучевая терапия — это основное и единственное средство лечения NPC. Лучевая терапия с модулированной интенсивностью (IMRT) является предпочтительным методом, поскольку она обеспечивает терапевтический эффект увеличения дозы для опухолевой ткани при снижении токсичности для нормальных тканей [10]. По сравнению с другими видами лечения, IMRT снижает токсичность, связанную с облучением, и может улучшить качество жизни, о котором сообщают пациенты NPC [11]. Заболевания IMRT, включая дерматит, одинофагию, фиброз шеи и плечевую плексопатию, связаны с большим полем целевых объемов шейных LN [12]. Определение подходящего клинического целевого объема для шейных LN при NPC все еще остается предметом дискуссий [13].
Определение подходящего клинического целевого объема для шейных LN при NPC все еще остается предметом дискуссий [13].
Программа эпиднадзора, эпидемиологии и конечных результатов (SEER) представляет собой хорошо отлаженный и обширный сбор данных из реестров рака по всей территории Соединенных Штатов [14]. Он включает почти все наборы данных о заболеваемости, распространенности, демографических и клинико-патологических данных рака. В этом исследовании мы стремились изучить факторы, связанные с частотой метастазов LN, и рассчитать отношения рисков (HR), общую выживаемость (OS) и выживаемость, специфичную для рака (CSS) у 2994 пациентов с NPC.Мы также проанализировали паттерны распределения LN и оценили категории метастазов LN, которые могут предсказать прогноз для 1884 пациентов с NPC с полной информацией об уровне поражения LN.
2. Материалы и методы
2.1. Популяция исследования
Программа SEER собирает данные из 18 оригинальных регистров, которые охватывают примерно 27,8% населения США. Мы использовали программу SEERStat версии 8.3.5 для извлечения данных из базы данных SEER. Мы включили пациентов, у которых с 2005 по 2016 год был диагностирован только первичный NPC, с использованием кода сайта C11 Международной классификации болезней O-3.0 – C11.9 и гистологические типы 8020, 8021, 8070–8073, 8082 и 8083. Пациенты исключались, если источником сообщения было вскрытие или свидетельство о смерти. Мы также исключили тех, у кого нет полной информации о стадии. В конечном итоге в это исследование были включены 2994 пациента.
Мы использовали программу SEERStat версии 8.3.5 для извлечения данных из базы данных SEER. Мы включили пациентов, у которых с 2005 по 2016 год был диагностирован только первичный NPC, с использованием кода сайта C11 Международной классификации болезней O-3.0 – C11.9 и гистологические типы 8020, 8021, 8070–8073, 8082 и 8083. Пациенты исключались, если источником сообщения было вскрытие или свидетельство о смерти. Мы также исключили тех, у кого нет полной информации о стадии. В конечном итоге в это исследование были включены 2994 пациента.
Показатели заболеваемости были скорректированы по возрасту с учетом стандартного населения США 2000 года. Годовое процентное изменение (APC) заболеваемости также рассчитывалось с конечной точкой через 1 год, а проверка значимости проводилась с помощью взвешенных наименьших квадратов.
Возраст был разделен на пять категорий: <40, 40–49, 50–59, 60–69 и> 70 лет. Расовая классификация: выходец из Азии / островов Тихого океана, белый, черный, индеец / коренной житель Аляски и неизвестен. Основываясь на схеме классификации Всемирной организации здравоохранения (ВОЗ), гистология была разделена на ороговевающую плоскоклеточную карциному (KSCC, коды SEER 8070, 8071; плоскоклеточный рак), некератинизирующую карциному (NKSCC, коды SEER 8020, 8021, 8072, 8073 и 8082; недифференцированные, анапластические, крупноклеточные и мелкоклеточные некератинизирующие карциномы и лимфоэпителиальная карцинома) и базалоидная плоскоклеточная карцинома (BSCC, код SEER 8083; базалоидная плоскоклеточная карцинома).Для постановки использовались 6-е (годы диагностики с 2006 по 2009) и 7-е (годы постановки диагноза с 2010 по 2016) выпуски AJCC. Основываясь на исследовании, которое продемонстрировало превосходство 7-го издания [15], мы реклассифицировали категорию T2a в 6-м издании на T1, а категорию T2b на T2. Уровни метастазов LN были закодированы на основе локально-специфических факторов совместной стадии (CS Site-specific Factors 3 и 4), включая уровни I, II, III, IV, V и заглоточные (rp) LN. Пациент с метастазами только I уровня был классифицирован как уровень 1, пациент с уровнем I и II был классифицирован как уровень 12 и т.
Основываясь на схеме классификации Всемирной организации здравоохранения (ВОЗ), гистология была разделена на ороговевающую плоскоклеточную карциному (KSCC, коды SEER 8070, 8071; плоскоклеточный рак), некератинизирующую карциному (NKSCC, коды SEER 8020, 8021, 8072, 8073 и 8082; недифференцированные, анапластические, крупноклеточные и мелкоклеточные некератинизирующие карциномы и лимфоэпителиальная карцинома) и базалоидная плоскоклеточная карцинома (BSCC, код SEER 8083; базалоидная плоскоклеточная карцинома).Для постановки использовались 6-е (годы диагностики с 2006 по 2009) и 7-е (годы постановки диагноза с 2010 по 2016) выпуски AJCC. Основываясь на исследовании, которое продемонстрировало превосходство 7-го издания [15], мы реклассифицировали категорию T2a в 6-м издании на T1, а категорию T2b на T2. Уровни метастазов LN были закодированы на основе локально-специфических факторов совместной стадии (CS Site-specific Factors 3 и 4), включая уровни I, II, III, IV, V и заглоточные (rp) LN. Пациент с метастазами только I уровня был классифицирован как уровень 1, пациент с уровнем I и II был классифицирован как уровень 12 и т.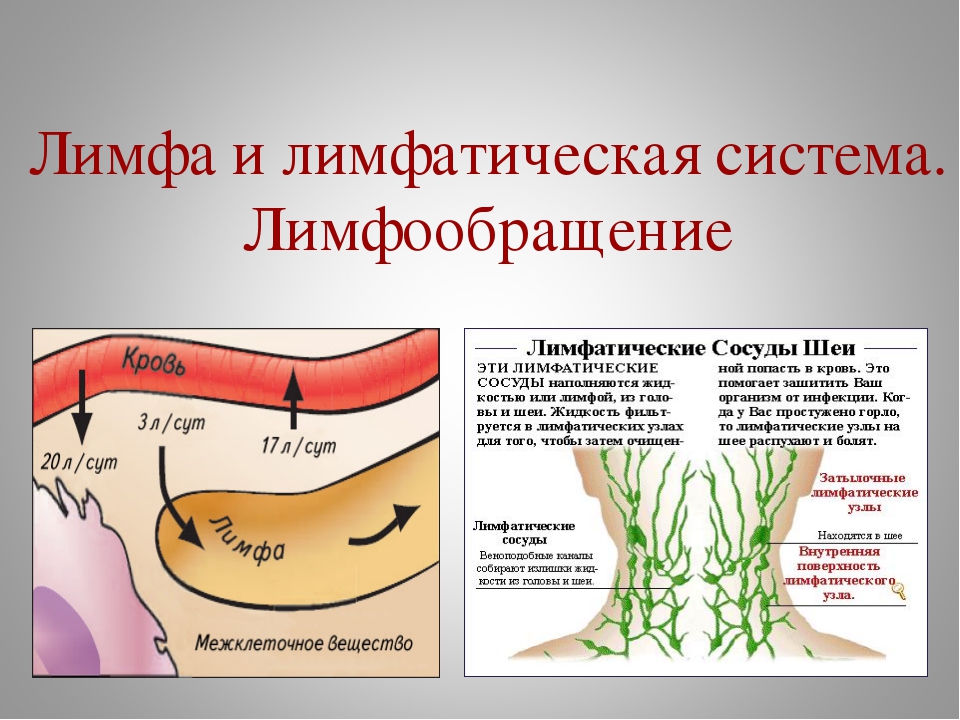 Д.Пациент, пропустивший уровень, будет соответственно классифицирован (например, уровень 124).
Д.Пациент, пропустивший уровень, будет соответственно классифицирован (например, уровень 124).
2.2. Статистический анализ
Сравнение категориальных переменных между пациентами с метастазами в ЛУ и без них проводилось с использованием критериев хи-квадрат. Пятилетние показатели OS и CSS рассчитывались с помощью анализа Каплана-Мейера, а различия в выживаемости оценивались с помощью лог-ранговых тестов. Логистическая регрессия использовалась для оценки категории риска метастазирования в LN для отдаленных метастазов. Мы рассчитали HR и их 95% доверительные интервалы (CI), используя многомерные модели регрессии пропорциональных рисков Кокса, чтобы оценить влияние категории соединений с метастазами LN на CSS.Все анализы проводились с использованием статистического программного обеспечения SPSS версии 25 (IBM Corporation). считался статистически значимым.
3. Результаты
3.1. Анализ заболеваемости
Мы собрали данные о заболеваемости с поправкой на возраст из исходных 18 участков реестра в базе данных SEER. Общая заболеваемость NPC в 2006–2015 гг. Составила 0,33 пациента на 100 000 населения (0,49 / 100 000 для мужчин и 0,19 / 100 000 для женщин). Годовые общие показатели заболеваемости за исследуемый период показаны на Рисунке 1.Они оставались стабильными (APC 1,45, 95% ДИ: -0,59–3,53,) с 2005 по 2016 год.
Общая заболеваемость NPC в 2006–2015 гг. Составила 0,33 пациента на 100 000 населения (0,49 / 100 000 для мужчин и 0,19 / 100 000 для женщин). Годовые общие показатели заболеваемости за исследуемый период показаны на Рисунке 1.Они оставались стабильными (APC 1,45, 95% ДИ: -0,59–3,53,) с 2005 по 2016 год.
3.2. Исходные характеристики пациентов
Всего было включено 2994 пациента с NPC, диагностированных в период с 2006 по 2015 год, в том числе 2139 (71,4%) мужчин и 855 (28,6%) женщин. Соотношение мужчин и женщин составляло 2,5: 1. Средний возраст на момент постановки диагноза составлял 54 года (от 8 до 99). Большинство пациентов были белыми (47,4%), за ними следовали выходцы из Азии / островов Тихого океана (37,7%), чернокожие (12,4%), американские индейцы / коренные жители Аляски (1.7%) и неизвестно (0,8%). Среди подтипов NPC у NKSCC была самая высокая частота — 55,6%, по сравнению с KSCC (43,0%) и BSCC (1,4%). Что касается стадии TNM, у 1610 (53,8%) пациентов был Т1 + Т2, 634 (21,2%) — Т3 и 750 (25,1%) — Т4; 1684 (56,2%) были N0 + N1, 906 (30,3%) были N2 и 404 (13,5%) были N3; 2695 (90,0%) были M0, а 299 (10,0%) были M1.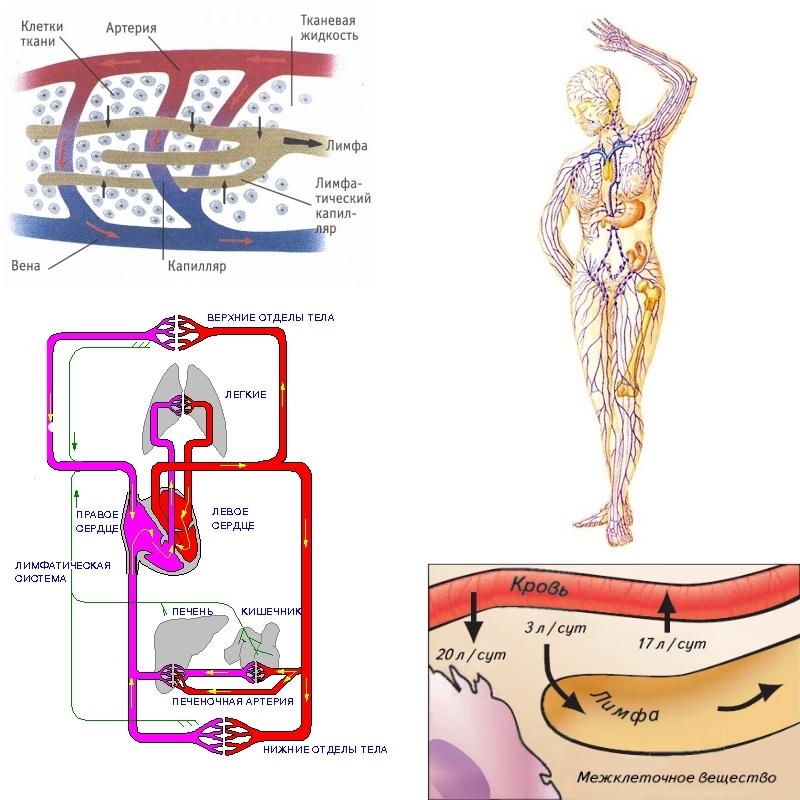
3.3. Факторы, связанные с метастазами в LN
Корреляции между характеристиками пациентов с NPC и статусом метастазов в LN показаны в таблице 1.У более молодых пациентов (возраст на момент постановки диагноза <40 лет) процент метастазов в ЛУ был значительно выше, чем у пациентов старшего возраста (85,6% против 82,4%, 76,9%, 71,3% для 40–49, 50–59, 60–69 и> 70 лет. лет соответственно). Что касается расы, группа американских индейцев / коренных жителей Аляски имела самый высокий уровень метастазов LN (82,7% против 80,2%, 74,0% и 77,6% у жителей азиатских / тихоокеанских островов, белых, чернокожих и американских индейцев / коренных жителей Аляски, соответственно, ). Метастазы в LN были менее распространены у пациентов с BSCC по сравнению с другими подтипами (60.5% против 75,1% и 78,5% для подтипов KSCC и NKSCC соответственно). Удивительно, но не было обнаружено значительной корреляции между частотой метастазов LN в зависимости от пола или стадии T (обе).
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
BSCC, базалоидная плоскоклеточная карцинома; LN — лимфатический узел; KSCC, ороговевающий плоскоклеточный рак; М — отдаленные метастазы; N, узел; NKSCC, некератинизирующая карцинома; Т, опухоль. a N0, нет; N1, односторонний шейный и / или односторонний или двусторонний заглоточный узел (узлы), ≤6 см в наибольшем измерении, выше надключичной ямки; N2, двусторонний шейный узел (узлы), ≤6 см в наибольшем измерении, выше надключичной ямки; N3, N3a:> 6 см в наибольшем измерении, над надключичной ямкой; N3b: в надключичной ямке.b 24 дела пропали без вести. c T1, носоглотка, ротоглотка или носовая полость; Т2 — парафарингеальное расширение; Т3, костные структуры и / или придаточные пазухи носа; Т4, внутричерепное расширение и / или черепные нервы, гипофаринкс, глазница или подвисочная ямка / жевательное пространство. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.4. Влияние стадии N на 5-летние показатели OS и CSS и результаты многомерного анализа
Показатели 5-летнего OS и CSS для всего населения составили 59,4% и 63.7% соответственно. Как показано в таблице 2, 5-летняя OS и CSS были значительно дольше в группе N0 + N1, чем в других группах (OS: 62,8% против 57,5% и 47,4% для стадий N2 и N3 соответственно; CSS: 67,7%). % против 60,9% и 51,1% для стадий N2 и N3 соответственно). У более молодых пациентов (<40 лет) ОВ и КСР были значительно дольше, чем у пациентов старшего возраста (ОС: 76,6% против 67,5%, 59,9%, 49,8% и 36,1% для 40–49, 50–59, 60–69 и> 70 лет соответственно; CSS: 78,5% против 68,8%, 63,8%, 54,4%, 47,4% для 40–49, 50–59, 60–69 и> 70 лет соответственно).Пациенты женского пола имели значительно более длительную ОВ и КСС, чем пациенты мужского пола (ОС: 64,1% против 57,6%; УС: 68,9% против 61,7%). Что касается расы, после исключения пациентов, отнесенных к категории неизвестных ( n = 24), у жителей азиатских / тихоокеанских островов были самые высокие показатели OS и CSS — 67,3% и 70,2% соответственно, в то время как у американских индейцев / коренных жителей Аляски были самые низкие OS и CSS — 43,8% и 45,3% соответственно. Среди гистологических подтипов у KSCC были самые низкие OS и CSS (OS: 48,2% против 67,9% и 61,8% в NKSCC и BSCC, соответственно; CSS: 53.8% против 71,1% и 66,8% в NKSCC и BSCC соответственно). Пациенты, которым было рекомендовано перенести операцию, имели лучшие показатели 5-летнего OS и CSS, чем те, которые не рекомендованы / неизвестны (OS: 65,9% против 58,2%; CSS: 71,5% против 62,3%). Всего 846 пациентов получили лучевую терапию, и их 5-летняя общая выживаемость и CSS были лучше, чем у пациентов без лучевой терапии (OS: 66,9% против 56,3%; CSS: 71,8% против 60,4%). Наконец, пациенты, проходящие химиотерапию, имели более высокие показатели 5-летнего OS и CSS, чем пациенты без химиотерапии (OS: 62.1% против 45,6%,; CSS: 65,9% против 52,4%,). Мы провели многомерный анализ с использованием регрессионного моделирования пропорциональных рисков Кокса и обнаружили, что возраст, пол, раса, тип гистологии, стадия TNM, операция, лучевая терапия и химиотерапия были значимыми независимыми прогностическими факторами для OS и CSS. По сравнению с группой N0 + N1, пациенты N2 имели ОР 1,311 (95% ДИ: 1,135–1,514) для ОВ, а группа N3 имела ОР 1,625 (95% ДИ: 1,357–1,945) для ОВ. Кроме того, пациенты N2 имели HR 1,351 для CSS (95% ДИ: 1.156–1,580,), а группа N3 имела ОР 1,630 для CSS (95% ДИ: 1,342–1,979,).
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
BSCC плоскоклеточный базалоидный карцинома; ДИ — доверительный интервал; CSS — выживаемость при раке; ЧСС, степень опасности; KSCC, ороговевающий плоскоклеточный рак; М — отдаленные метастазы; N, узел; NKSCC, некератинизирующая карцинома; NPC, рак носоглотки; ОС — общая выживаемость; Т, опухоль. a Пятилетняя OS и CSS для субъектов неизвестной расы составили 73,4% и 77,7% соответственно. b T1, носоглотка, ротоглотка или носовая полость; Т2 — парафарингеальное расширение; Т3, костные структуры и / или придаточные пазухи носа; Т4, внутричерепное расширение и / или черепные нервы, гипофаринкс, глазница или подвисочная ямка / жевательное пространство. c N0, нет; N1, односторонний шейный и / или односторонний или двусторонний заглоточный узел (узлы), ≤6 см в наибольшем измерении, выше надключичной ямки; N2, двусторонний шейный узел (узлы), ≤6 см в наибольшем измерении, выше надключичной ямки; N3, N3a:> 6 см в наибольшем измерении, над надключичной ямкой; N3b: в надключичной ямке. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.5. Заболеваемость и распространение метастазов в LN
В исследование были включены 2299 (76,8%) пациентов с лимфаденопатией (классифицированные как N1, N2 или N3). Распределение было следующим: 404 (17,6%) случаев на уровне I, 1515 (65,9%) на уровне II, 670 (29,1%) на уровне III, 360 (15,7%) на уровне IV, 588 (25,6%) на уровне V и 311 (13,5%) на уровне rp. Представлен 81 случай с поражением ЛУ III уровня без вовлечения ЛУ II уровня. Мы также выявили 49 случаев поражения ЛУ на уровне IV без поражения на уровне II и III.Частота пропуска метастазов составила 5,7% (130/2299).
3.6. Категории риска метастазов в LN для отдаленных метастазов
После исключения 415 пациентов с неполной информацией об уровне метастазов в LN, 1884 пациента были в конечном итоге развернуты. Уровень 2 является наиболее часто встречающейся категорией метастазов в ЛУ у пациентов с НПК с поражением ЛУ (30,0% из 1884 подходящих пациентов). Далее следуют уровни 23 (8,5%), уровень 1 (5,5%), уровень 5 (5,3%), уровни 25 (5,3%), уровни 12 (4,0%), уровни 2345 (3.9%), уровни 235 (3,8%), уровни 2rp (3,2%), уровни 234 (3,1%), уровень rp (2,4%), уровень 3 (2,2%), уровни 23rp (2,1%), уровни 24 (1,5%). %) и др. (19,4%). Таблица 3 показывает, что, взяв уровень 2 в качестве эталона, пациенты с уровнем 1 имели OR 2,101 (95% ДИ: 1,090–4,047) для отдаленных метастазов, уровни 2345 имели наивысшее отношение OR 4,064 (95% ДИ: 2,155–7,666). ,) для отдаленных метастазов, а уровни 24 имели OR 3,003 (95% ДИ: 1,074–8,395) для отдаленных метастазов после поправки на возраст, пол и расу, которые также были статистически значимыми при одномерном анализе.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
ДИ, доверительный интервал; LN — лимфатический узел; NPC, рак носоглотки; ИЛИ — отношение шансов; rp, заглотка. Уровень 2 означает пациентов с метастазами в ЛУ только второго уровня. Уровень 23 означает пациентов с метастазами в ЛУ уровня II и III и т. Д.Многомерный анализ с поправкой на возраст, пол и расу. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3,7. Прогностические значения категорий метастазов в LN для CSS у пациентов с NPC
Как показано в таблице 4, уровни 235 имели статистически значимый HR 1,708 (95% ДИ: 1,089–2,678) для CCS по сравнению с уровнем 2 после поправки на возраст. пол, раса, гистология, стадия TNM и стратегии лечения, хотя ранее это статистически не значимо (). Уровень 3 имел значительный HR 1,709 (95% ДИ: 1.017–2.873,) в одномерном анализе; однако он снизился до 1,602 (95% ДИ: 0,938–2,737) без статистической значимости ().
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
ДИ, доверительный интервал; CSS — выживаемость при раке; ЧСС, степень опасности; LN — лимфатический узел; rp, заглотка. Уровень 2 означает пациентов с метастазами в ЛУ только уровня II, Уровень 23 означает пациентов с метастазами в ЛУ уровня II и III и т. Д.Многомерный анализ с поправкой на возраст, пол, расу, гистологию, стадию TNM и лечение (лучевая терапия, хирургия и химиотерапия). | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
4. Обсуждение
NPC — это злокачественная опухоль эпителиальной ткани, частота и смертность от которой зависит от расы, пола, возраста и страны [16]. В нашем исследовании общая заболеваемость NPC в США с 2006 по 2015 год составляла 0,33 на 100 000 населения. Вероятность развития заболевания у мужчин в два-три раза выше, чем у женщин, а максимальный возраст возникновения заболевания составляет от 50 до 60 лет [1], что было аналогично нашим результатам (соотношение мужчин и женщин 2.6: 1). Хотя почти во всех азиатских исследованиях сообщалось о значительном снижении заболеваемости NPC [16], мы обнаружили, что в нашем исследовании заболеваемость в США оставалась стабильной.
В ретроспективном когортном исследовании, проведенном Challapalli и его коллегами, пациенты из Азии / Тихого океана имели самый высокий уровень заболеваемости NPC, но у них также был самый высокий 5-летний уровень CSS, в то время как американские индейцы / коренные жители Аляски имели самую низкую выживаемость [17]. Ли и Ко проанализировали эпидемиологические закономерности и выживаемость пациентов с NPC с помощью статистической программы SEER и обнаружили, что плохая выживаемость была связана с более старым возрастом, мужским полом и гистологией KSCC [18].Лучевая терапия — основное и единственное средство лечения NPC [19]. Мета-анализ, изучающий эффекты сопутствующей химиотерапии с адъювантной химиотерапией и без нее при NPC, продемонстрировал улучшение OS [20]. Sun et al. выполнили ретроспективный популяционный анализ и предоставили доказательства положительного влияния операции на выживаемость при NPC [21]. Последние достижения в области лечения улучшили клинические результаты, что привело к увеличению выживаемости пациентов с NPC. Наши результаты также показывают, что 5-летняя общая выживаемость была больше для пациентов, которым было рекомендовано хирургическое вмешательство или которые получали лучевую или химиотерапию, по сравнению с пациентами, которые не получали лечения.
NPC обычно проявляется метастазами в LN, 36–45% пациентов с NPC имеют начальные симптомы шейного лимфаденэктаза, а 60–90% имеют метастазы в шейные LN при диагнозе NPC [22]. Мета-анализ Ho et al. выявили, что 85% из 2920 китайских пациентов с NPC, поставленных с помощью МРТ, имели поражение LN на момент постановки диагноза [23], что выше нашего результата (76,8%). Мы обнаружили, что пол и стадия Т не были связаны с метастазами в ЛУ, что согласуется с отчетом Томиты и его коллег [24].Они обнаружили, что метастазы LN не коррелировали с половыми различиями, включая образ жизни и биологические особенности (например, половые гормоны). Их исследование разделило пациентов на две группы (≤60 и> 60 лет) и обнаружило, что возраст существенно не коррелировал с частотой метастазов LN. Однако мы разделили возраст на пять групп и обнаружили, что у более молодых пациентов (<40 лет) была значительно более высокая частота метастазов в ЛУ, чем у пациентов старшего возраста. Влияние возраста на метастазы в ЛУ остается спорным.Что касается стадии T, Lv et al. обследовали 1067 пациентов с поражением ЛУ в группах T1-T2 и T3-T4 и не обнаружили значимой корреляции между стадией T и поражением узлов [25]. Это говорит о том, что стадии T и N зависят от биологического поведения опухоли. Следовательно, целесообразно принимать решения о клиническом лечении, основываясь на стадиях T и N, а не на общей стадии. Патологический тип NPC по классификации ВОЗ имеет разные клинические характеристики и прогностическую информацию; это в значительной степени связано с частотой метастазов в шейные LN.Одно ретроспективное исследование показало, что пациенты с NKSCC показали более высокую частоту метастазов в LN, чем пациенты с KSCC [24], что соответствовало нашим результатам. Другой ретроспективный популяционный анализ показал, что частота метастазов в LN для BSCC составляет 53,7% [26], что ниже нашего показателя 60,5%.
Фактическое распределение метастазов в лимфоузлы, описанное в терминах уровня LN, различается в разных исследованиях. Большинство из них сообщили, что LN уровня II и заглоточные LN были первыми, на кого метастазировали, с общей вероятностью 60–80% [23, 25].Chua et al. обнаружили 29,1% поражение ретрофарингеальных ЛУ [27]. Наши результаты показали, что вероятность поражения ЛУ уровня II и ретрофарингеального ЛУ составила 65,9% и 13,5% соответственно. Эти расхождения могут быть связаны с методами обнаружения переменных и диагностическими стандартами. Метастазы в ретрофарингеальные LN изоденсны и прилегают к первичной опухоли и, таким образом, не могут быть идентифицированы как отдельное образование на КТ [7]. Превосходный контраст мягких тканей при МРТ кажется лучшим вариантом для идентификации ЛУ.Эти факторы могли повлиять на низкую частоту поражения ретрофарингеальных ЛУ по сравнению с другими сообщениями. В нескольких недавних исследованиях сообщалось, что метастазирование в LN при NPC происходит упорядоченным образом от более высокого уровня к низкому уровню LN, а пропуск метастазирования встречается редко, в диапазоне от 0,5% до 7,9% [28, 29]. Общая частота пропуска метастазов в нашей серии составила 5,7%.
Метастатические узлы от NPC связаны с плохим исходом, особенно в случаях с объемными узлами (> 6 см), некрозом или узлами в нижней части шеи [30, 31].По сравнению с группой N0 + N1, группа N2 имела ОР 1,311 (95% ДИ: 1,135–1,514,) для OS и 1,351 для CSS (95% ДИ: 1,156–1,580), в то время как группа N3 имела ОР. 1,625 (95% ДИ: 1,357–1,945,) для ОС и 1,630 для CSS (95% ДИ: 1,342–1,979). Хотя узловые метастазы связаны с худшим прогнозом, рекомендации по лечению, корреляция между метастазами в LN и отдаленными метастазами, а также то, как опухолевые клетки попадают в кровоток через LN, все еще остаются дискуссионными. Два недавних исследования на мышах показали, что отдаленные метастазы вызываются прямой инвазией опухолевых клеток в кровеносные сосуды LN [32], а не через грудной проток [33].Чтобы изучить влияние метастазов LN на отдаленные метастазы, мы классифицировали подходящих пациентов по категориям метастазов LN (например, уровень 2, уровень 23, уровень 1, уровень 5 и уровни 25). Насколько нам известно, это первый популяционный метод. анализ для использования категории соединений метастазов LN, чтобы предоставить доказательства воздействия метастазов LN на отдаленные метастазы и выживаемость в NPC. Приняв уровень 2 в качестве эталона, уровень 1 имел OR 2,101 (95% CI: 1,090–4,047), а уровни 24 имели OR 3,003 (95% CI: 1.074–8.395,) для отдаленных метастазов с поправкой на возраст, пол и расу. Примечательно, что категория уровней 2345 имела самый высокий OR 4,064 (95% ДИ: 2,155–7,666) для отдаленных метастазов. При анализе выживаемости уровни 235 имели статистически значимый HR 1,708 (95% ДИ: 1,089–2,678) для CSS по сравнению с уровнем 2 после поправки на возраст, пол, расу, гистологию, стадию TNM и стратегии лечения, в то время как это было не было статистически значимым ранее (HR = 1,518, 95% ДИ: 0,989–2,329,).
Наши результаты следует интерпретировать с осторожностью из-за ограничений, связанных с использованием базы данных SEER.Во-первых, в базе данных не указаны методы обнаружения или диагностические критерии вовлечения LN. Во-вторых, мы не включили хорошо известные прогностические факторы, такие как узловой некроз, экстракапсулярное распространение узлов или латеральность. Остается неизвестным, изменит ли учет этих факторов выводы исследования. Тем не менее, наши результаты свидетельствуют о влиянии категории метастазов LN на отдаленные метастазы и выживаемость в NPC.
5. Выводы
Частота поражения LN у пациентов с NPC различалась по возрасту, расе, гистологическому типу и стадии M, но не по полу или стадии T.Если взять уровень 2 в качестве эталона, уровень 1, уровни 2345 и уровни 24 имеют значительно более высокие риски отдаленных метастазов после корректировки на возраст, пол и расу. Уровни 235 имели статистически значимый HR 1,708 для CSS по сравнению с уровнем 2 после корректировки на возраст, пол, расу, гистологию, стадию TNM и лечение.
Доступность данных
Все данные были получены из базы данных эпиднадзора, эпидемиологии и конечных результатов (SEER). Данные доступны у соответствующего автора по запросу.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов в отношении публикации этой статьи.
Вклад авторов
Яли Сюй и Таоюань Хуан внесли равный вклад в эту работу.
Выражение признательности
Авторы признают усилия реестров опухолей Программы надзора, эпидемиологии и конечных результатов (SEER) по созданию базы данных SEER.
Статус шейных лимфатических узлов на выживаемость регионально рецидивирующей или персистирующей карциномы носоглотки
Участники и описательные данные
Сорок шесть пациентов с регионально рецидивирующими или персистирующими NPC перенесли спасательную диссекцию шеи в больнице принца Уэльского в период с июня 2001 г. по январь 2013 г. с демографическими и исходными характеристиками, приведенными в таблице 1.Преобладание мужчин составило 74% (34 пациента). Средний возраст составлял 53 года (диапазон 31–90). Среднее время наблюдения после рассечения шеи составило 44,67 месяца (диапазон 0–151). Семь пациентов были потеряны для наблюдения после первого года. В когорте не было пациентов с патологией N0, все были EBER-положительными и ассоциированы с EBV.
Для первичного лечения 19 пациентам была проведена только лучевая терапия носоглотки и шеи, а 27 пациентам было проведено одновременное химиотерапевтическое облучение на основе цисплатина.Сорок четыре пациента (95,7%) имели узловую болезнь во время их первоначального лечения от NPC.
Для диагностики регионального рецидива 32 пациентам (70%) был поставлен ультразвуковой диагноз, 19 (41%) — контрастная КТ, 19 — ПЭТ-КТ (41%) и 23 — МРТ (50%). У 14 пациентов (30%), которым не проводилось УЗИ, диагноз был поставлен либо с помощью контрастной КТ, МРТ, ПЭТ-КТ или комбинации этих трех. Что касается пациентов с радиологически или клинически подозрительными лимфатическими узлами, 37 пациентов (80%) имели FNAC с 32 пациентами с положительными результатами, что составляло 86% от тех, кто имел FNAC.Остальные пациенты с очень подозрительными лимфатическими узлами, несмотря на неубедительный или доброкачественный результат FNAC, перешли к диссекции шеи. Локальный рецидив был выявлен с помощью эндоскопического исследования носоглотки (9 пациентов, 20% участников) отдельно или в дополнение к контрастной КТ, МРТ или ПЭТ-КТ у остальных.
Тридцать шесть пациентов перенесли одностороннее рассечение шеи, а десять пациентов — двустороннее расслоение шеи, в результате чего за период исследования было выполнено 56 рассечений шеи.Особенности рассечения шеи приведены в таблице 2. Из рассечения шеи 33 были слева и 23 справа. Кроме того, 26 были радикальными рассечениями шеи и 30 были модифицированными радикальными рассечениями шеи. При патологическом исследовании образца расслоения шеи 57% имели болезнь N1, 39% — болезнь N2 и 4% — болезнь N3.
Таблица 2 Особенности диссекции шеи.Данные о результатах
Уровень II был наиболее часто пораженной узловой областью шейки матки со злокачественными лимфатическими узлами, выявленными на этом уровне в 32 образцах рассечения шеи (57.1%), затем следует уровень III с положительными узлами в 18 образцах (32,1%), уровень I с положительными узлами в 11 образцах (19,6%) и уровень IV с положительными узлами в 10 образцах (17,9%). Уровень V и уровень VI (когда он был рассечен) были наименее часто встречающимися уровнями с поражением узлов у шести (10,7%) и трех образцов (5,3%), соответственно.
Экстракапсулярное распространение имело место у 31 (67,4%) пациента. Среднее количество положительных лимфатических узлов, общее количество исследованных лимфатических узлов и плотность лимфатических узлов составляли 4.3 (диапазон 0–14), 26,4 (диапазон 1–90) и 22,6% (диапазон 1,82–100%) соответственно. Пациенты с экстракапсулярным распространением наблюдались для обсуждения адъювантной терапии.
В общей сложности 23 пациента (50%) согласились на адъювантную терапию. Типами адъювантной терапии были лучевая терапия (12 пациентов), брахитерапия (8 пациентов), брахитерапия с химиотерапией (1 пациент) и только химиотерапия (1 пациент). 18 из 23 пациентов завершили курс адъювантной терапии. Все 4 пациента из 23, которые не завершили адъювантную терапию, имели общую 5-летнюю смертность на 100%, в то время как 11 пациентов выжили (70%) через 5 лет.Те, кто выжил после завершения постадъювантной терапии, были 6 из группы адъювантной терапии (50% из группы адъювантной лучевой терапии) и 4 из группы брахитерапии (50% из группы брахитерапии).
Всего 12 пациентов (26,1%) имели послеоперационный локорегиональный рецидив. Среднее время до локорегионального рецидива после рассечения шеи составило 21 месяц (6–56 месяцев). Из пациентов с местно-регионарным рецидивом после расслоения шеи у 3 пациентов (6,5%) был изолированный регионарный рецидив, у 4 пациентов (8.7%) имели изолированный местный рецидив. У 7 пациентов (15,2%) были как местные, так и региональные рецидивы. Два пациента (4,3%) имели как изолированный регионарный рецидив, так и отдаленные метастазы, а 4 пациента (8,7%) имели локорегиональный рецидив с отдаленными метастазами. Положительное количество лимфатических узлов, плотность лимфатических узлов, экстракапсулярное распространение и общее количество лимфатических узлов из образца рассечения шеи независимо от положительного или отрицательного результата не показали значимой связи с послеоперационным локорегиональным рецидивом.
Когда были построены кривые ROC для количества положительных лимфатических узлов и плотности лимфатических узлов, а также общего количества лимфатических узлов в образце, пороговые значения были определены как 5 лимфатических узлов (чувствительность = 0,61, специфичность = 0,68) и 20 процентов (чувствительность = 0,72, специфичность = 0,71) и 12 лимфатических узлов (чувствительность = 0,80, специфичность = 0,96) соответственно.
Основные результаты
OS, DSS, LRRFS и RRFS для нашей когорты составили 56,50%, 73,90%, 87% и 91,30% соответственно.Анализ выживаемости Каплана-Мейера был построен для анализа лимфатических узлов и исходных характеристик, и результаты были суммированы в таблице 3. Анализ показал, что пациенты с большим количеством положительных лимфатических узлов имели значительно худшую общую выживаемость (p <0,01), DSS (p <0,01) и LRRFS (p <0,01). Пациенты с числом положительных лимфатических узлов более 5 имели значительно более низкую ОС (p <0,01), DSS (p <0,01) и LRRFS (p = 0,12), как показано на рис. 1. Пациенты с более высокой плотностью лимфатических узлов имели нижняя ОС (p <0.01) и DSS (p = 0,023). Те, у кого плотность лимфатических узлов более 20% показали значительно более низкую ОС (p <0,01), DSS (p <0,01) и LRRFS (p = 0,018), как показано на рис. 1. Общее количество лимфатических узлов не показало связи с выживание. Пациенты с более высокой патологической рецидивирующей стадией N также имели значительно худшие ОС (p <0,01) и DSS (p <0,01). Экстракапсулярное распространение не показало значимых результатов в отношении выживаемости. Пациенты, которые пьют, имели более низкую ОС (p <0,01) и DSS (p <0,01).Ни возраст, ни курение, ни пол пациентов не оказали существенного влияния на одномерный анализ. Результаты одномерного анализа обобщены в таблице 3.
Таблица 3 Одномерный анализ. Рис. 1Кривые выживаемости Каплана-Мейера для числа положительных лимфатических узлов более пяти и плотности лимфатических узлов более двадцати процентов. Примечания: ОС = общая выживаемость; DSS = выживаемость при конкретном заболевании; LRRFS = выживаемость без локорегионального рецидива. LN + ve> 5: количество положительных лимфатических узлов более пяти; LND> 20%: плотность лимфатических узлов более двадцати процентов.
Многофакторный анализ выживаемости с регрессией пропорциональных рисков был построен для исходных характеристик и анализа лимфатических узлов со сводкой результатов в таблице 4. Общее количество лимфатических узлов было исключено из-за отсутствия связи с выживаемостью в одномерном анализе. Результаты показали, что у пациентов с числом положительных лимфатических узлов более пяти снизилась ОС (отношение рисков = 6,93, 95% ДИ = 1,56–30,70, p = 0,01), DSS (отношение рисков = 7,11, 95% ДИ 1,51–33,47, р = 0.01) и LRRFS (отношение рисков = 15,53, 95% ДИ 1,24–194,50, p = 0,03). Плотность лимфатических узлов более 20% свидетельствует о снижении ОВ (отношение рисков = 7,60, 95% ДИ 1,13–51,10, p = 0,037). Что касается исходных факторов, у пьющих пациентов была более низкая ОС (отношение рисков = 13,25, 95% ДИ 2,62–66,95, p <0,01). Отказ от курения был защитным фактором (отношение рисков = 0,07, 95% ДИ 0,01–0,82, p = 0,03). Пациенты в возрасте старше 50 лет имели значительно более низкую ОВ (отношение рисков = 10,50, 95% ДИ 1,66–66.42, p = 0,01) и DSS (отношение рисков = 7,73, 95% ДИ 1,36–44,03, p = 0,02). Наличие завершенного курса адъювантной терапии, патологическая стадия лимфатических узлов шеи и пол не были существенно связаны с выживаемостью в многофакторном анализе.
Таблица 4 Многомерный анализ.Результаты проспективного многоцентрового клинического исследования
Введение
Метастаз в шейных лимфатических узлах носоглотки карцинома (NPC) имеет заболеваемость до 70% (1) и является ключевым фактором, влияющим на клиническая стадия NPC, план лечения и прогноз (2).Текущий существующий международный стандарты для постановки NPC взяты из 7-го издания Союз по международному контролю рака / Американский объединенный комитет по Система стадирования рака (UICC / AJCC), которая в первую очередь основана на пальпация (3,4). Пальпация лимфатических узлов обычно зависит от на субъективность врачей, что может помешать точность постановки и разработка индивидуального лечения планы. В предыдущие годы лучевая терапия с модуляцией интенсивности (IMRT) стала важной терапией для NPC (5–12).Как тип прецизионной лучевой терапии, IMRT требует точной анатомической локации; однако 7-е издание промежуточной системы UICC / AJCC включены положения поверхности тела, которые используются для определение метастазов в шейных лимфатических узлах (13). Например, в этой промежуточной системе надключичная ямка (SCF) определяется как область треугольника, образованная верхний край грудинного конца ключицы, верхний край наружного конца ключицы и шеи-плеча пересечение; однако эта область может включать в себя область IV и хвост V области в международной перегородке шейных лимфатических узлов система (14).Следовательно, SCF, a положение, не имеющее точного позиционирования в поперечных сечениях в визуализации, не может удовлетворить требования IMRT. Таким образом, 7-я редакция промежуточной системы UICC / AJCC имеет определенные ограничения относительно контура целевых областей NPC, определение планы лечения и оценка прогноза (15).
Изначально онкологическая группа лучевой терапии (RTOG) разделяет шейные лимфатические узлы на заглоточную область, I (Ia, Ib) область, II (IIa, IIb) область, III область, IV область, V регион и VI регион (16).В дальнейшем ретростилоидное пространство и надключичная область включен в модифицированную версию стандартов разделения RTOG (17). В 2013 году стандарты дивизиона RTOG далее определены области IVb, Vc, VII, VIII, IX и X (18). Признанный во всем мире шейный Стандарты разделения изображений лимфатических узлов широко используются среди Сообщество исследователей радиационной онкологии. В настоящем исследовании использовался RTOG разделение стандартов и магнитно-резонансной томографии (МРТ) на исследовать метастазы NPC в шейных лимфатических узлах и установить новый стандарт постановки N для NPC на основе IMRT через перспективный многоцентровое клиническое исследование.
Материалы и методы
Пациенты
С января 2006 г. по декабрь 2009 г., 492 пациента с NPC без отдаленных метастазов из шести больниц (Первая Аффилированная больница Медицинского университета Гуанси, Наньнин; Лючжоу Больница для рабочих, Лючжоу; Первая народная больница города Юйлинь, Юлин; Народная больница Гуанси-Чжуанского автономного района, Наньнин; Аффилированная больница Гуйлиньского медицинского университета, Гуйлинь; Госпиталь Красного Креста Учжоу, Учжоу, Гуанси, Китай) были включены в настоящее исследование.Среди них 338 мужчин и 154 женщины. Средний возраст группы составлял 45 лет (от 18 до 81 года). Старый). Все пациенты получали IMRT. Пациенты с Карновским статус работоспособности ≥70, которые соответствовали критериям анализа крови и другие тесты (например, креатинин сыворотки ≤1,6 мг / дл и билирубин сыворотки ≤1,5 мг / дл; лейкоциты ≥3,600 / мм3, тромбоциты ≥100000 / мм3 и гемоглобин ≥12,0 г / дл для мужчин, ≥11,0 г / дл для женщин). Перед лечением все пациенты прошел подробный медицинский осмотр, общая ситуация оценка, рутинное исследование крови, носоглоточный фиброскоп обследование, рентген грудной клетки или компьютерная томография (КТ) брюшной полости УЗИ и МРТ областей, включая носоглотку и шею.Пациентам со стадией N2-N3 проводилось дополнительное сканирование костей. Все процедуры были одобрены этическим комитетом Guangxi Medical Университет (Наньнин, Китай). Письменное информированное согласие было получено от всех пациентов или их семей до включения в настоящее исследование.
МРТ
МРТ изображения были получены с помощью МРТ-сканера 1,5 Тл (GE Healthcare Life Sciences, Литтл-Чалфонт, Великобритания). Все пациенты получил маршрутизацию и расширенное сканирование. Направления сканирования были поперечный, сагиттальный, коронарный, T2-взвешенный (TR 3000–4000 мс, TE 102–110 мс), T1-взвешенный (TR 2200–2400 мс, TE 77–109 мс, TI 750 мс) и улучшенное сканирование с взвешиванием по T1.Головка квадратурной катушки была принята, толщиной 6 мм, межслоевым интервалом 1 мм и матрица 256 × 192. Поперечное сканирование варьировалось от супраселлярного цистерна к нижнему краю ключицы. Контрастное вещество было гадопентетат димеглумин-диэтилентриаминпентацетат, с доза 15 мл.
Клиническая стадия
Все МРТ-изображения были независимо рассмотрены с использованием система архивирования изображений и коммуникации двух врачей. В этап данной исследовательской группы определен согласно 7-й редакция стандарта клинической стадии UICC / AJCC с учетом Симптомы пациента и информация о физикальном обследовании.Лимфатический узел метастазы диагностированы с помощью МРТ, а не пальпации, по данным рекомендации RTOG редакции 2013 г. (19,20).
Лечебный метод
В общей сложности 492 пациента с NPC прошли IMRT. в течение всего процесса. Компьютерная томография с контрастным усилением сканирование проводилось от черепа до 3 см ниже ключицы, с расстоянием между слоями 3 мм и толщиной слоя 3 мм. Под руководству Отчета 50 и Отчета 62 Международной комиссии по единицам излучения и измерениям, общий объем опухоли (GTV) включены первичные участки опухоли и диапазон их инвазии (GTVnx), ретрофарингеальные метастатические лимфатические узлы (GTVrpn) и шейные метастатический лимфатический узел (GTVnd) (21).Диапазон клинического целевого объема (CTV) можно регулировать в соответствии с степени вовлеченности. Например, CTV1 должен включать GTVnx, GTVrpn, вся слизистая оболочка носоглотки и подслизистая область 5 мм; CTV2 должен включать CTV1, а также некоторые из следующего: Задняя полость носа, крылонебно-небная ямка, задняя челюсть пазуха, часть задней решетчатой пазухи, латеральная глотка пространство, основание черепа, часть шейного позвонка и наклон. Планирование объем цели (PTV) включал ошибки положения и движения органов во время процедур, которые обычно расширяются снаружи на 3-5 мм на основе GTV и CTV.Рецептурные дозы были следующими: PGTVnx и PTVrpn (68–74 Гр), PTVnd (66–70 Гр), PTV1 (60–66 Гр) и PTV2 (50–56 Гр; 5 фракций в неделю, всего 30–33 фракции). Установлены ограниченные дозировки для критических органов. международный консенсус (21,22).
Все этапы определены согласно 7-й редакции стандартов постановки UICC / AJCC. Из 477 пациентов со стадией II – IVB заболевание, 93,70% пациентов (461/492) получали химиотерапию, в том числе 51,0% (235/461) с сопутствующей химиотерапией, 37.09% (171/461) с индукцией + одновременная химиотерапия, 7,59% (35/461) с сопутствующей + адъювантной химиотерапией, 4,12% (19/461) с индукционная + сопутствующая + адъювантная химиотерапия и 0,22% (1/461) с индукционной химиотерапией. Химиотерапевтические препараты были в первую очередь на основе платины. Все центры использовали идентичную химиотерапию. протоколы.
Последующие действия
Регулярное наблюдение началось через 3 месяца после пациенты закончили лечение. Срок наблюдения определялся как период от даты начала лечения до последняя дата регулярного наблюдения или время смерти пациенты.К 31 декабря 2014 г., последняя дата очередного наблюдения, средний срок наблюдения составил 64,1 месяца (6–92 месяцы). 96,3% пациентов прошли полное наблюдение. данные 5 лет. Основные факторы анализа включали в себя: выживаемость (OS), безрецидивная выживаемость (DFS), безрецидивная выживаемость (RFS) и отдаленная выживаемость без метастазов (DMFS).
Статистический анализ
Все результаты были проанализированы с помощью SPSS v19.0 статистическое программное обеспечение (IBM Corp., Армонк, Нью-Йорк, США). Каплан-Мейер Метод использовался для расчета различных показателей выживаемости.Лог-ранг был использован для проверки значимости различий в процент выживаемости. Анализ прогнозов проводился с использованием одномерный анализ или многомерный анализ. P <0,05 было считается, что это указывает на статистически значимое различие. Данные представлены как среднее значение ± стандартная ошибка среднего.
Результаты
Скорость метастазирования в лимфатические узлы NPC высокий, заглоточные и II регионарные лимфатические узлы являются наиболее вероятны метастазы
Для определения распределения метастатической лимфы узлов, места метастазирования зафиксированы для всех 492 пациенты с NPC.Среди 492 пациентов 428 (87%) имели шейный метастазы в лимфатические узлы, в том числе 82 (19,2%) случая с левым только цервикальный метастаз, 77 (18,0%) случаев с правым шейным только метастазы и 269 (62,9%) случаев с метастазами в шейку матки обе стороны. Количество пациентов с заглоточным лимфатическим узлом метастазирование составило 339 (79,2%), в том числе 128 случаев двустороннего метастазы (38,1%) и 210 случаев односторонних метастазов (61,9%). Количество пациентов с метастазами в регионарные лимфатические узлы составило 351 (82.0%), в том числе 189 случаев двусторонних метастазов (44,2%; Таблица I). Среди 428 пациентов с метастазы в лимфатические узлы, только 4 пациента без II регионарной метастазы имели III регионарный метастаз (0,9%), в том числе 1 случай которые продемонстрировали регионарные метастазы IV, Va и Vb. Среди пациентов без региональных метастазов II и III, без региональных метастазов IV наблюдалось. Эти результаты свидетельствуют о том, что скорость лимфатических узлов метастаз NPC был высоким, с заглоточным и II регионарным лимфатические узлы с наибольшей вероятностью будут иметь метастазы.
Таблица I.Доля и распределение метастатические лимфатические узлы у 428 пациентов с NPC. |
Таблица I.
Доля и распределение метастатические лимфатические узлы у 428 пациентов с NPC.
| Кол-во пациентов (%) | ||||
|---|---|---|---|---|
| Уровень | Левый | Правый | Двусторонний | Итого |
| Ia | 0 (0.0) | 0 (0,0) | 0 (0,0) | 0 (0,0) |
| Ib | 3 (0,7) | 6 (1,4) | 1 (0,2) | 8 (1,9) |
| II | 254 (59,3) | 286 (66,8) | 189 (44,2) | 351 (82,0) |
| III | 104 (24,3) | 99 (23,1) | 35 (8,2 ) | 168 (47,4) |
| IVa | 21 (4,9) | 15 (3.5) | 4 (0,9) | 32 (7,5) |
| IVb | 1 (0,2) | 0 (0,0) | 0 (0,0) | 1 (0,2) |
| VA | 10 (2,3) | 8 (1,9) | 1 (0,2) | 17 (4,0) |
| Vb | 4 (0,9) | 5 (1,2) | 0 (0,0) | 9 (2,1 ) |
| Vc | 1 (0,2) | 1 (0,2) | 0 (0,0) | 2 (0.5) |
| VI | 0 (0,0) | 0 (0,0) | 0 (0,0) | 0 (0,0) |
| VIIa | 239 (55,8) | 228 (53,3) | 129 (38,1) | 339 (79,2) |
| VIIb | 0 (0,0) | 0 (0,0) | 0 (0,0) | 0 (0,0) |
| VIII | 0 (0,0) | 0 (0,0) | 0 (0,0) | 0 (0,0) |
| IX | 0 (0.0) | 0 (0,0) | 0 (0,0) | 0 (0,0) |
| Xa | 0 (0,0) | 0 (0,0) | 0 (0,0) | 0 (0,0) |
| Xb | 0 (0,0) | 0 (0,0) | 0 (0,0) | 0 (0,0) |
Задноглоточные лимфатические узлы шейные уровень лимфатических узлов и латеральность шейных лимфатических узлов связаны с прогнозом пациентов
Чтобы исследовать связь между лимфатическими узлами характеристики и прогноз, одномерный анализ и многомерный был проведен анализ.Согласно 7 изданию Система стадирования UICC / AJCC, пациенты I, II, III, IVa и IVb этапы составили 3,0% (15/492), 14,4% (71/492), 35,8% (176/492), 38,0% (187/492) и 8,7% (43/492) соответственно. В Кроме того, пациенты на стадиях T1, T2, T3 и T4 составили 6,7%. (33/492), 18,5% (91/492), 33,7% (166/492) и 41,1% (202/492), соответственно. Кроме того, пациенты N0, N1, N2, N3a и N3b ступени составили 13,0% (64/492), 32,3% (159/492), 45,9% (226/492), 2,2% (11/492) и 6.5% (32/492), соответственно (данные не показано). Показатель ОС через 5 лет составил 80,5%, показатель DFS был 78,6%, показатель RFS составил 94,1%, а показатель DMFS — 84,3%. Однофакторный анализ 428 пациентов с шейным лимфатическим узлом метастазирование продемонстрировало, что уровень лимфатических узлов, размеры [измеренные как максимальный диаметр (Dmax)] имел статистически значительное влияние на OS, DFS и DMFS, шейный лимфатический узел латеральность и заглоточная область имели статистически значительное влияние на ОС, DFS, RFS и DMFS, а также на экстракапсулярную распространение оказало статистически значимое влияние на ОС, тогда как некроз разжижения не оказал значительного эффекта (Таблица II).Кроме того, отдаленные метастазы выживаемость и общая выживаемость в Ib, заглотке (VIIa), III и Va области существенно не отличались от II области, тогда как в областях IVa, Vb и ниже были значительно отличается от II региона. Следовательно, уровни лимфатических узлов были разделены на две группы: уровень 1 (L1), заглоточные (VIIa), Ib, II, III и Va регионы; и уровень 2 (L2), IVa, IVb, Vb и Vc регионов (Таблица III). Многомерный анализ всех 492 пациентов показал, что Dmax шейные лимфатические узлы, экстракапсулярное распространение и разжижение некроз не имел самостоятельного прогностического значения.Отметить, заглоточные лимфатические узлы, уровень шейных лимфатических узлов и шейный Латеральность лимфатических узлов была независимым прогностическим фактором (Таблица IV). Эти результаты показали, что заглоточные лимфатические узлы, уровень шейных лимфатических узлов и шейный латеральность лимфатических узлов связана с прогнозом пациенты.
Таблица II.Одномерный анализ связь между различными переменными шейных лимфатических узлов и прогноз пациента. |
Таблица II.
Одномерный анализ связь между различными переменными шейных лимфатических узлов и прогноз пациента.
| Переменные | OS | χ 2 | P-значение | DFS | χ 2 | P-значение | RFS 922 922 922 922 922 922 922 922 922 922 922 922 922 | DMFS | χ 2 | Значение P | ||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Уровень | 30.003 | <0,001 | 22,774 | 0,001 | 1,170 | 0,978 | 31,184 | <0,001 | ||||
| Уровень ИБ | — | – | – | – | ||||||||
| Уровень II | 82,7 | 81.9 | 94,4 | 87,7 | ||||||||
| Уровень III | 75,2 | 73,6 | 93,3 | 79,9 | ||||||||
| Уровень IVa | 67,0 | 65,6 | 93.3 | 71,9 | ||||||||
| Уровень Вирджиния | 92,3 | 65,9 | 91,7 | 74,0 | ||||||||
| Уровень Вб | 37,0 | 44,4 | 100 | 44.4 | ||||||||
| Уровень (IVb + Vc) | 33,3 | 33,3 | 100 | 33,3 | ||||||||
| Уровень VIIa | 78,9 | 86,5 | 91,7 | 85,9 | ||||||||
| Группа | 12.109 | 0,001 | 10,682 | 0,001 | 0,062 | 0,803 | 13,792 | <0,001 | ||||
| Уровень 1 | 79,8 | 78,0 | 93,6 | 83,9 | ||||||||
| Уровень 2 | 39,2 | 59.1 | 95,0 | 63,6 | ||||||||
| D макс , см | 14,566 | 0,001 | 15,728 | <0,001 | 0,575 | 0,750 | 14,068 | 0,001 | ||||
| ≤3 | 81,0 | 77,3 | 93.6 | 83,3 | ||||||||
| > 3 и ≥6 | 78,1 | 76,4 | 94,8 | 81,3 | ||||||||
| > 6 | 45,5 | 36,4 | 90,9 | 45.5 | ||||||||
| Поперечность | 12,640 | <0,001 | 11,866 | 0,001 | 4,645 | 0,031 | 6,682 | 0,010 | ||||
| Односторонний | 89,2 | 86,3 | 97,6 | 88,5 | ||||||||
| Двусторонний | 71.2 | 70,3 | 92,0 | 77,7 | ||||||||
| РЛН | 17,872 | 0,046 | 14,199 | <0,001 | 4,710 | 0,030 | 8,970 | 0,003 | ||||
| Нет | 96,2 | 91.9 | 98,9 | 93,0 | ||||||||
| Есть | 73,3 | 71,9 | 92,3 | 78,9 | ||||||||
| Экстракапсулярный спред | 6,071 | 0,014 | 1,700 | 0.192 | 0,001 | 0,976 | 1,921 | 0,166 | ||||
| Нет | 86,0 | 79,4 | 93,7 | 85,4 | ||||||||
| Есть | 73,8 | 74,5 | 93,9 | 80.2 | ||||||||
| Некроз | 0,426 | 0,514 | 1,754 | 0,185 | 2,636 | 0,104 | 0,315 | 0,574 | ||||
| Нет | 78,2 | 77,2 | 94,7 | 82,2 | ||||||||
| Да | 72.7 | 70,2 | 89,0 | 80,2 |
Таблица III.Сравнение отдаленных метастазов выживаемость и ОС на разных уровнях лимфатических узлов. |
Таблица III.
Сравнение отдаленных метастазов выживаемость и ОС на разных уровнях лимфатических узлов.
| Коэффициент риска (95% CI) | |||
|---|---|---|---|
| Узловой переменные | № | Отдаленные метастазы выживание | OS |
| Уровень II | 196 | 1 | 1 |
| Уровень VIIa | 37 | 0,998 (0,382–2,607) | 1,080 (0,475–2,452) |
| Уровень III | 138 | 1.565 (0,909–2,697) | 1,520 (0,934–2,474) |
| Уровень IVa | 32 | 2,357 (1.100–5.050) a | 2.124 (1.041–4.335) a |
| Уровень Va | 13 | 1.779 (0,537–5,893) | 0,462 (0,063–3,381) |
| Уровень Vb | 9 | 6,318 (2.415–16.532) a | 5.302 (2.057–13.667) a |
| Уровень (IVb + Vc) | 3 | 10.559 (2.492–44.750) a | 10.491 (2.483–44.318) a |
| Ib уровня | 0 | — | — |
Таблица IV.Многомерный анализ шейки матки переменные лимфатических узлов, связанные с прогнозом. |
Таблица IV.
Многомерный анализ шейки матки переменные лимфатических узлов, связанные с прогнозом.
| Переменные | OS | DFS | RFS | DMFS | ||||
|---|---|---|---|---|---|---|---|---|
| Уровни 1 и 2 | 0,007 | 0,003 | 0,003 | D макс. | 0,918 | 0,764 | 0,793 | 0,945 |
| Поперечность | 0,006 | 0,006 | 0,004 | 0,007 | ||||
| RLN | <0.001 | <0,001 | <0,001 | 0,001 | ||||
| Экстракапсулярный спред | 0,909 | 0,999 | 0,962 | 0,925 | ||||
| Некроз | 0,242 | 0,424 | 0,232 | 0,193 |
Новая ступенчатая система N, предложенная в настоящее исследование больше подходит для IMRT по сравнению с 7-м редакция промежуточной системы UICC / AJCC
По данным одномерного и многомерного анализа результаты, 492 пациента, включенные в настоящее исследование, были разделены на шесть подгрупп, включая группу N0 (без лимфы метастаз в узле), группа заглоточных лимфатических узлов (Nrp), L1Lu группа (односторонние метастазы в верхние шейные лимфатические узлы), группа L1Lb (двусторонний метастаз в верхние шейные лимфатические узлы), группа L2Lu (односторонние метастазы в нижние шейные лимфатические узлы) и группа L2Lb (двустороннее метастазирование нижних шейных лимфатических узлов).По сравнению с L1Lu группа (отношение рисков = 1), отношение рисков для риска выживаемость при отдаленных метастазах и общая выживаемость в группе N0 было 0. Таким образом, группа N0 была отнесена к стадии N0. По сравнению с L1Lu группа (отношение рисков = 1), отношение рисков для риска выживаемость при отдаленных метастазах в группе Nrp составила 1,367, а риск общей выживаемости составила 1,857. Статистически L1Lu и Nrp группы не имели существенной разницы. Таким образом, группы L1Lu и Nrp были отнесены к стадии N1.Однако коэффициент риска для риска выживаемости при отдаленных метастазах и общей выживаемости в L1Lb группа составила 2,142 и 2,755 соответственно, что значительно по сравнению с таковым в группе L1Lu (P <0,05). Таким образом, группа L1Lb была классифицируется как стадия N2. По сравнению с группой L1Lu опасность соотношение риска отдаленных метастазов и общей выживаемости. выживаемость в группе L2Lu (3.825 и 3.835 соответственно), а в группе группа L2Lb (4,785 и 5,415 соответственно) также была значительно выше (P <0.05). Таким образом, группы L2Lu и L2Lb были отнесены к стадии N3 (табл. V). В зависимости от влияния различных факторов на прогноз, в настоящем исследовании предложены новые стандарты стадии N: N0 (без лимфы метастаз в узел), N1 [заглоточный и / или односторонний верхний шейный (I, II, III, Va, VIIb, VIII, IX и X области) лимфатический узел метастаз], N2 [двусторонний верхний шейный отдел (I, II, III, Va, VIIb, VIII, IX и X области) метастаз в лимфатический узел] и N3 (лимфатический узел метастазы в области IVa и Vb и их нижние области).К оценить новую стадию N, различия в выживаемости значение прогноза, баланс распределения и коэффициент риска были сравнивают постановку романа N и 7-е издание Промежуточная система UICC / AJCC. В предлагаемой новой ступенчатой системе N, кривые ОС существенно различались на всех этапах: N0: N1 (χ2 = 5,198, P <0,05), N0: N2 (χ2 = 14,663, P <0,01), N0: N3 (χ2 = 29,990, P <0,01), N1: N2 (χ2 = 9,215, P <0,01), N1: N3 (χ2 = 22,592, P <0,01) и N2: N3 (χ2 = 9,305, P <0,01). Кроме того, Кривые DMFS существенно различались на всех этапах: N0: N1 (χ2 = 5.528, P <0,05), N0: N2 (χ2 = 11,748, P <0,01), N0: N3 (χ2 = 25,172, P <0,01), N1: N2 (χ2 = 8,525, P <0,01), N1: N3 (χ2 = 18,934, P <0,01) и N2: N3 (χ2 = 7,315, P <0,01; Рис.1, таблица VI). И наоборот, кривые OS и DMFS существенно не различались между стадиями N3a и N3b согласно 7-й редакции промежуточной системы UICC / AJCC (Рис. 1, Таблица VI). Кроме того, соотношение распространение в этапах N3a и N3b в 7-м издании На промежуточную систему UICC / AJCC пришлось 2,2 и 6,5% соответственно, тогда как ступень N3 в предлагаемой новой ступенчатой системе N приходилось 8.9%, более сбалансирован по сравнению с 7-м. редакция промежуточной системы UICC / AJCC (Таблица VII). Кроме того, коэффициент риска для каждый этап предлагаемой новой ступенчатой системы N был значительно отличается по сравнению со стадией N0 (P <0,05), тогда как риск соотношение для этапа N1 в 7-м выпуске этапа UICC / AJCC система существенно не отличалась от ступени N0 (P> 0,05; Таблица VII). Эти результаты показали, что новая ступенчатая система N, предложенная в настоящее исследование больше подходит для IMRT по сравнению с 7-м. редакция промежуточной системы UICC / AJCC.
Таблица V.Схемы распределения и сбой опасности различных N подмножеств. |
Таблица V.
Схемы распределения и сбой опасности различных N подмножеств.
| Коэффициент опасности (95% CI) | ||
|---|---|---|
| Группа | Отдаленные метастазы выживание | OS |
| L1Lu | 1 | 1 |
| N0 | 0.152 (0,020–1,166) | 0,271 (0,061–1,201) |
| Nrp | 1,367 (0,481–3,879) | 1,857 (0,071–4,657) |
| L1Lb | 2,142 (1,129–4,064) б | 2,755 (1.499–5.065) a |
| L2Lu | 3.825 (1.079–13.556) b | 3.835 (1.092–13.471) a |
| L2Lb | 4,785 (2.181–10.497) b | 5.415 (2.537–11.562) a |
Таблица VI.Частота ОС и удаленная безотказность скорости различных N этапов между предлагаемой системой и 7-м редакция системы UICC / AJCC. |
Таблица VI.
Частота ОС и удаленная безотказность скорости различных N этапов между предлагаемой системой и 7-м редакция системы UICC / AJCC.
| ОС | DMFS | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| X2 | P | X2 | P | ||||||
| Предлагается система | |||||||||
| N0: N1 | 5.198 | 0,039 | 5,528 | 0,042 | |||||
| N0: N2 | 14,663 | <0,001 | 11,748 | <0,001 | |||||
| N0: N3 | 29,990 0,0056 | <0,001 | |||||||
| N1: N2 | 9,215 | 0,001 | 8,525 | 0,002 | |||||
| N1: N3 | 22,592 | <0,001 | 18,934 | <0.001 | |||||
| N2: N3 | 9,305 | <0,001 | 7,315 | <0,001 | |||||
| UICC / AJCC система | |||||||||
| N0: N1 | 4.203 | 0,040 | 4,325 | 0,038 | |||||
| N0: N2 | 14,104 | <0,001 | 11,197 | 0,001 | 39223 | <0.001 | 39,328 | <0,001 | |
| N0: N3b | 34,506 | <0,001 | 31,973 | <0,001 | |||||
| N1: N2 | 11,438 | 0,001 | 0,001 | 0,01||||||
| N1: N3a | 35,277 | <0,001 | 28,276 | <0,001 | |||||
| N1: N3b | 34,218 | <0,001 | 31,427 | <0.001 | |||||
| N2: N3a | 6.544 | 0,011 | 9,797 | 0,002 | |||||
| N2: N3b | 9,510 | 0,002 | 12,721 | <0,001 30 | N3b12,721 | <0,001 32 | N30,728 | 0,070 | 0,792 |
Таблица VII.Распределение и различия в рисках соотношения между 7-м изданием промежуточной системы UICC / AJCC и предлагаемая новая ступенчатая система N. |
Таблица VII.
Распределение и различия в рисках соотношения между 7-м изданием промежуточной системы UICC / AJCC и предлагаемая новая ступенчатая система N.
| Коэффициент риска (95% CI) | |||
|---|---|---|---|
| N стадия | № | Отдаленные метастазы выживание | OS |
| Предлагается система | |||
| N0 | 64 (13.0) | 1 | 1 |
| N1 | 161 (32,7) | 7,557 (1.009–56.613) a | 4.596 (1.077–19.609) a |
| N2 | 223 (45.3) | 13.827 (1.903–100.486) a | 10.000 (2.431–41.132) a |
| N3 | 44 (8.9) | 30.123 (3.993–227.251) а | 18.584 (4.282–80.651) a |
| UICC / AJCC система | |||
| N0 | 64 (13.0) | 1 | 1 |
| N1 | 159 (32,3) | 6,316 (0,834–47,812) | 3,955 (0,917–17,050) |
| N2 | 226 (45,9) | 13,288 (1.827–96.612) a | 9.719 (2,361–40,006) a |
| N3 a | 11 (2,2) | 51,936 (6.243–432.084) a | 36.384 (7.268–182.153) a |
| N3b | 32 (6.5) | 38,744 (5.091–294.830) a | 23.544 (5,369–103,245) a |
Обсуждение
NPC имеет высокий уровень шейных лимфатических узлов. метастазы и у ~ 70% пациентов диагностировали шейную лимфатическую метастазирование узла при их предварительном диагнозе (1,23). МРТ данные настоящего исследования показали, что 87,0% из 492 пациентов метастазы в лимфатические узлы, что согласуется с результатами сообщается Wang et al (24) и Хо и др. (25).В частота метастазов в заглотку, II, III, IV, Va, Vb и Vc регионы составляли 79,2, 82,0, 47,4, 7,7, 4,0, 2,1 и 0,5%, соответственно. В соответствии с предыдущим исследованием метастатический ставки каждого региона снизились от верхнего к нижнему. регион, а частота пропуска метастазов составила 0,9% (26). Однако это не было подтверждено. является ли ретрофарингеальный лимфатический узел или лимфатический узел II области дозорным лимфатический узел (1,27–30). Ур. и др. (31) показали, что частота метастазов в ретрофарингеальные лимфатические узлы и лимфатические узлы II области была 74.5 и 75,3% соответственно, что позволяет предположить, что оба являются дозорными. лимфатический узел. В соответствии с этим наблюдением настоящее исследование продемонстрировали, что частота метастазов ретрофарингеального и II области лимфатических узлов у 428 пациентов были 351 случай (82,0%) и 339 случаев (79,2%) соответственно. Это наблюдение может быть связано с дренированием лимфатических узлов через заглоточную и II области. в 7-е издание системы стадирования UICC / AJCC, ретрофарингеальная лимфа метастаз в узел был классифицирован как N1 (32). Tang et al (33) рекомендовали классифицировать заглоточную метастазы в лимфатические узлы как N1.Результаты настоящего исследования выявили, что метастазирование в заглоточные лимфатические узлы (независимо от сторон и размеров) является независимым прогностическим фактором, влияющим на OS, DFS, RFS и DMFS пациентов с NPC. Из-за различных N стандарты стадирования NPC, которые имеют различные параметры лимфатических узлов (15,20,29,34,35), в настоящем исследовании предлагается установить единый стандарт, основанный на объективные данные МРТ и международное отделение визуализации лимфатических узлов метод.
Надключичная ямка, определенная в 7-м издании промежуточная система UICC / AJCC продемонстрировала высокую риск отдаленных метастазов.Согласно RTOG для Lymph Node критериев, надключичная ямка расположена в IV области, нижняя часть V области и вся надключичная область (13). Шейные лимфатические узлы упорядочены. система защиты. Как только поражаются надключичные лимфатические узлы, опухолевые клетки могут в дальнейшем проникать в грудные протоки и, возможно, в все тело. Мао и др. (34) предположили, что регионы метастазов лимфатических узлов можно разделить на категории в заглоточную, Ib, II, III, V и IV области, а также в надключичная область, при использовании N стадий на основе МРТ и RTOG для оценки рисков отдаленных метастазов.Нг и др. (15) и Yue et al (36) предложили заменить надключичные fossae в стандартах UICC / AJCC с областями IV и Vb. Ли и др. al (37) показали, что нижняя метастазы в шейных лимфатических узлах (IV, Vb и надключичные области) является независимым прогностическим фактором, влияющим на выживаемость (37). В соответствии с этими отчетами В настоящем исследовании уровень лимфатических узлов был разделен на уровень 1. (заглоточная, Ib, II, III и Va области) и Уровень 2 (IVa, IVb, Vb и Vc), а также одномерный и многомерный анализ подтвердили существенные различия в прогнозе между два.
NPC обычно метастазирует по направлению лимфодренажа (38). Как есть отличается от других злокачественных опухолей головы и шеи, NPC обычно имеет метастазы в лимфатические узлы (двусторонние или односторонние) во время его ранняя стадия, с 40% частотой двусторонних метастазов в лимфатические узлы (39). Основное различие между Этапы N1 и N2 в 7-й редакции промежуточной системы UICC / AJCC односторонний или двусторонний метастаз в лимфатические узлы. Настоящее исследование продемонстрировали, что показатели OS, DFS, RFS и DMFS были значительно различаются между односторонними и двусторонними метастазами, что позволяет предположить латеральность шейных лимфатических узлов является независимым прогностическим фактор для NPC.
Предыдущий обзор литературы, исследующий данные для системы N-staging для NPC показало, что прогностический значение, приписываемое размеру, было спорным (40–44). Ли и др. (4) продемонстрировали, что самый большой размер лимфатических узлов был независимо значимым в прогнозирование выживания. Однако некоторые отчеты показали, что лимфа размер узла не был независимым прогностическим фактором (40–43). В Многофакторный анализ настоящего исследования показал, что лимфатический узел размер не был независимым прогностическим фактором.По седьмому редакция системы стадирования UICC / AJCC, диагностика лимфы узлы> 6 см были в первую очередь основаны на пальпации, то есть субъективно. Некоторые лимфатические узлы размером> 6 см можно диагностировать с помощью МРТ или КТ. Таким образом, вопрос о том, должен ли размер лимфатических узлов быть включены в стандарты стадии N.
Прогностическое значение экстракапсулярного распространения в лечении НПЦ остается неясным. Мао и др. (34) предположили, что экстракапсулярные лимфатические узлы распространение должно быть отнесено к стадии N2 как фактор стадии.В результаты одномерного анализа настоящего исследования продемонстрировали, что экстракапсулярное распространение существенно не влияют на скорости RFS, DMFS и DFS. Кроме того, многомерный анализ указали, что экстракапсулярное распространение шейных лимфатических узлов не было независимый прогностический фактор. Это может быть связано с отсутствием патологические свидетельства и диагностический стандарт. Следовательно, экстракапсулярное распространение не входит в предложенный роман N постановочная система.
Система стадирования опухолевых узлов и метастазов — это комплексное проявление всех типов факторов прогноза выявленные исследованиями клинической эпидемиологии, и идентификация новых прогностических факторов зависит от улучшение диагностики и терапии.Из-за непрерывного улучшение диагностики и терапии, прогностические факторы также меняется, и система постановки также должна постоянно улучшаться. Опубликован стандарт постановки 7-го издания UICC / AJCC. в 2009 г. преимущественно базируется на данных регулярных двумерных лучевая терапия. По мере развития точной лучевой терапии IMRT имеет чаще применялись при лечении NPC, чем обычные двумерная лучевая терапия (44–46). В кроме того, 7-е издание UICC / AJCC в основном основано на пальпация (3,4).Пальпация лимфатических узлов обычно зависит от на субъективность врачей, что может помешать точность постановки и разработка индивидуального лечения планы (34). Предыдущие исследования продемонстрировали отсутствие значимых различий в DMFS между N3a и N3b, и предположил, что N3a и N3b могут быть объединены как N3 в романе N стадия (47,48). В В настоящем исследовании использовались стандарты разделения RTOG и МРТ для изучения метастазы в шейных лимфатических узлах NPC, и установить новый N стандарт постановки NPC на основе IMRT в перспективном мультицентре клиническое испытание.Было предложено, чтобы новая ступенчатая система N включают: N0 (без метастазов в лимфатические узлы), N1 [заглоточный и / и односторонние верхние шейные (I, II, III, Va, VIIb, VIII, IX и X области) метастазы в лимфатические узлы], N2 [двусторонний верхний шейный (I, II, III, Va, VIIb, VIII, IX и X области) метастазы в лимфатические узлы] и N3 (метастазы в лимфатические узлы в областях IVa и Vb и их нижних регионов). По сравнению с 7-м выпуском постановки UICC / AJCC система, новая ступенчатая система N позволила улучшить разницу в рисках и баланс распределения, а также отличная скорость DMFS и скорость ОС между этапами.В заключение, новая ступенчатая система N более подходит для IMRT и более точно предсказывает прогноз пациенты с NPC.
Благодарности
Не применимо.
Финансирование
Настоящее исследование поддержано грантами Национальный фонд естественных наук Китая (гранты № 81460460, 81360405 и 81760542), Исследовательский фонд науки и Технологический департамент провинции Гуанси, Китай (гранты № 2016GXNSFAA380252 и 2014GXNSFBA118114), Guangxi Medical Программа университетской подготовки для выдающихся молодых ученых (2017), Руководство центрального правительства по местным наукам и технологиям девелоперские проекты (ZY18057006).Финансирование премии за выдающиеся достижения в области медицины грантом на развитие творческих исследований от первого Аффилированная больница Медицинского университета Гуанси.
Наличие данных и материалов
Все данные, полученные или проанализированные в ходе этого исследования, включены в эту опубликованную статью.
Авторские работы
MK и RW разработали исследования и присвоили задачи командам. PZ, TW, TZ и JL собрали и проанализировали данные. МК получил доступ к соответствующей информации. GL и HY помогли с МРТ экспертиза.ML и GF участвовали в анализе изображений. JZ был участвует в статистическом анализе. RW, GL, HY, GF, ML и JZ критически переработал рукопись для важных интеллектуальных содержание. RW одобрил окончательную версию рукописи как Отправлено.
Утверждение этических норм и согласие на участвовать
Все процедуры одобрены этическим комитетом. Медицинского университета Гуанси (Наньнин, Китай). Письменное информирование согласие было получено от всех пациентов или их семей до зачисление в настоящее исследование.
Согласие на публикацию
Не применимо.
Конкурирующие интересы
Авторы заявили, что у них нет конкурирующих интересы.
Список литературы
1 | Тан Л., Мао И, Лю Л., Лян С., Чен Ю., Сунь Y, Liao X, Lin A, Liu M, Li L и Ma J: объем облучения. при селективном облучении шеи при раке носоглотки: Анализ картины распространения в лимфатических узлах с помощью магнитного резонансная томография.Рак. 115: 680–688. 2009. Просмотр статьи: Google Scholar: PubMed / NCBI |
2 | И Дж, Гао Л., Хуан Х, Ло Дж, Сяо Дж, Ли С., Ван К., Чжан С., Цюй И и Сюй Г.: Карцинома носоглотки, которую лечили Лучевая терапия с модуляцией интенсивности: отдаленные результаты 416 случаев. пациенты. Чин Дж Радиат Онкол. 21: 196–200. 2012. |
3 | Эдж С.Б. и Комптон СС: Американский Джойнт Комитет по раку: 7-е издание оценки стадии рака AJCC руководство и будущее TNM.Энн Сург Онкол. 17: 1471–1474. 2010 г. Просмотр статьи: Google Scholar: PubMed / NCBI |
4 | Ли А.В., Фу В., Пун Ю.Ф., Ло К.К., Чан DKOSK, Tung SY и Ho JH: Стадия рака носоглотки: Оценка N-стадии с помощью систем Ho и UICC / AJCC. Союз Internationale Contre le Cancer. Американский объединенный комитет по Рак. Clin Oncol (R Coll Radiol). 8: 146–154. 1996. Просмотреть статью: Google Scholar: PubMed / NCBI |
5 | Ли А.В., Сзе В.М., Ау Дж.С., Люнг С.Ф., Люн Т.В., Chua DT, Zee BC, Law SC, Teo PM, Tung SY и др.: Результаты лечения рака носоглотки в современную эпоху: Гонконг опыт.Int J Radiat Oncol Biol Phys. 61: 1107–1116. 2005 г. Просмотр статьи: Google Scholar: PubMed / NCBI |
6 | Lee AW, Lin JC и Ng WT: Текущий лечение рака носоглотки. Семин Радиат Онкол. 22: 233–244. 2012. Просмотр статьи: Google Scholar: PubMed / NCBI |
7 | Вонг ФК, Нг А.В., Ли В.Х., Луи СМ, Юэн К.К., Sze WK, Leung TW и Tung SY: Одновременная работа на всем поле лучевая терапия с модуляцией интенсивности с интегрированным усилением для пациентов с рак носоглотки.Int J Radiat Oncol Biol Phys. 76: 138–145. 2010. Просмотр статьи: Google Scholar: PubMed / NCBI |
8 | Ли Н., Харрис Дж., Гарден А.С., Штрауб В., Глиссон Б., Ся П., Бош В., Моррисон В. Н., Куиви Дж., Торстад В. и др. al: Лучевая терапия с модуляцией интенсивности с или без химиотерапия рака носоглотки: лучевая терапия исследование фазы II группы онкологии 0225. J Clin Oncol. 27: 3684–3690. 2009. Просмотр статьи: Google Scholar: PubMed / NCBI |
9 | Ли Н, Ся П, Куиви Дж. М., Синхронный К., Пун I, Акадзава С., Акадзава П., Вайнберг В. и Фу К.К .: Модулированная по интенсивности лучевая терапия при лечении рака носоглотки: An обновление опыта UCSF.Int J Radiat Oncol Biol Phys. 53: 12–22. 2002. Просмотр статьи: Google Scholar: PubMed / NCBI |
10 | Ли А.В., Лау У.Х., Тунг С.И., Чуа Д.Т., Чаппелл R, Xu L, Siu L, Sze WM, Leung TW, Sham JS и др.: Предварительно результаты рандомизированного исследования терапевтического эффекта от одновременных химиотерапия при регионально распространенной карциноме носоглотки: Испытание NPC-9901, проведенное гонконгской группой по изучению рака носоглотки. J Clin Oncol. 23: 6966–6975. 2005 г.Просмотр статьи: Google Scholar: PubMed / NCBI |
11 | Линь С., Пань Дж., Хан Л., Чжан Х, Ляо Х и Лу Дж.Дж .: Карцинома носоглотки лечится уменьшенным объемом лучевая терапия с модуляцией интенсивности: отчет о 3-летнем исходе из предполагаемой серии. Int J Radiat Oncol Biol Phys. 75: 1071–1078. 2009. Просмотр статьи: Google Scholar: PubMed / NCBI |
12 | Кам МК, Леунг С.Ф., Зи Б., Чау Р.М., Суен Дж.Дж., Mo F, Lai M, Ho R, Cheung KY, Yu BK и др.: Проспективные рандомизированные исследование лучевой терапии с модуляцией интенсивности на слюнной железе функции у пациентов с раком носоглотки на ранней стадии.J Clin Онкол. 25: 4873–4879. 2007. Просмотр статьи: Google Scholar: PubMed / NCBI |
13 | Эдж С.Б., Берд Д.Р., Комптон СС, Фриц АГ, Грин Ф.Л. и Тротти A: Руководство AJCC по стадированию рака. 7-е изд. Новый Йорк, Нью-Йорк: Спрингер; 2010 |
14 | Сом PM, Curtin HD и Mancuso AA: Узловая классификация на основе изображений для оценки шеи метастатическая аденопатия. AJR Am J Roentgenol. 174: 837–844.2000 г. Просмотр статьи: Google Scholar: PubMed / NCBI |
15 | Нг В.Т., Ли А.В., Кан В.К., Чан Дж., Панг Э.С., Яу Т.К. и Лау К.Ю.: N-стадия магнитно-резонансной томографии для пациенты с карциномой носоглотки: тип узловых вовлечение по радиологическим уровням. Радиотренажер Oncol. 82: 70–75. 2007. Просмотр статьи: Google Scholar: PubMed / NCBI |
16 | Грегуар В., Левендаг П., Анг К.К., Бернье Дж., Брааксма М., Будач В., Чао С., Коче Э., Купер Дж. С., Коснард Дж. И др.: Определение уровней лимфатических узлов и связанных с ними CTV на основе КТ в узел-отрицательная шея: DAHANCA, EORTC, GORTEC, NCIC, консенсус RTOG методические рекомендации.Радиотренажер Oncol. 69: 227–236. 2003. Просмотр статьи: Google Scholar: PubMed / NCBI |
17 | Грегуар V, Эйсбрух А., Хамуар М и Levendag P: Предложение по разграничению узлового CTV в положительный узел и послеоперационная шейка. Радиотренажер Oncol. 79: 15–20. 2006. Просмотр статьи: Google Scholar: PubMed / NCBI |
18 | Грегуар V, Анг К., Будах В., Грау С., Hamoir M, Langendijk JA, Lee A, Le QT, Maingon P, Nutting C и др.: Определение уровней шейных узлов при опухолях головы и шеи: A Обновление 2013 г.DAHANCA, EORTC, HKNPCSG, NCIC CTG, NCRI, RTOG, TROG согласованные руководящие принципы. Радиотренажер Oncol. 110: 172–181. 2014 г. Просмотр статьи: Google Scholar: PubMed / NCBI |
19 | Гао И, Ху Ц, Инь Х, Гуопэй З, Лин К., Xiayun H, Tingting X, Xiaoshen W, Jing Y, Suqin W и др.: Лечение результаты рака носоглотки: ретроспективный анализ 1837 дел в одном институте. Чин Дж Радиат Онкол. 17: 335–339. 2008. |
20 | Китайская клиническая стадия карцинома носоглотки: рак носоглотки ’92 стадии отчет о работе по модификации.Чин Дж Радиат Онкол. 18: 2–6. 2009. |
21 | Консенсусные руководящие принципы 2010 г. Целевая область лучевой терапии с модуляцией интенсивности и расчет дозы для лечения рака носоглотки. Чин Дж Радиат Онкол. 20: 267–269. 2011. |
22 | Ли Н, Чжан К., Ким Дж., Гарден А.С., Mechalakos J, Hu K, Le Q, Glisson BS, Chan AT и Pfister DG: Фаза II исследование сопутствующей и адъювантной химиотерапии с интенсивностью модулированная лучевая терапия (IMRT) или трехмерная конформная лучевая терапия (3D-CRT) + бевацизумаб (BV) на местном или региональном уровне распространенный рак носоглотки (NPC) [RTOG 0615]: предварительный отчет о токсичности.Int J Radiat Oncol Biol Phys. 78 Приложение: S103 – S104. 2010. Просмотр статьи: Google Scholar |
23 | Гу Х: лучевая терапия опухолей. Пекин: Издательство Медицинского колледжа Пекинского союза; С. 443–448. 2008 |
24 | Ван XS, Ян Ц., Ху CS, Ин Х.М., Хэ XY, Zhou ZR и Ding JH: Исследование ретрофарингеального узла медиальной группы метастаз от карциномы носоглотки на основании 3100 впервые выявленных диагностированные случаи.Oral Oncol. 50: 1109–1113. 2014. Просмотр статьи: Google Scholar: PubMed / NCBI |
25 | Хо ФК, Тхам И.В., Эрнест А, Ли К.М. и Лу JJ: Паттерны метастазов регионарных лимфатических узлов носоглотки карцинома: метаанализ клинических данных. BMC Рак. 12: 982012. Просмотр статьи: Google Scholar: PubMed / NCBI |
26 | Ван XS, Ху К.С., Инь Х.М., Чжоу З.Р., Дин Дж.Х. и Feng Y: Паттерны метастазов ретрофарингеального узла у рак носоглотки.Int J Radiat Oncol Biol Phys. 73: 194–201. 2009. Просмотр статьи: Google Scholar: PubMed / NCBI |
27 | Король А.Д., Ахуджа А.Т., Люнг С.Ф., Лам В.В., Тео P, Chan YL и Metreweli C: Метастазы в шейном узле из карцинома носоглотки: МРТ паттернов заболевания. Глава Шея. 22: 275–281. 2000. Просмотр статьи: Google Scholar: PubMed / NCBI |
28 | Ван Х, Ли Л, Ху Ц, Чжоу З, Ин Х, Дин Дж. и Feng Y: Паттерны метастазирования узлов уровня II в носоглотке. карцинома.Радиотренажер Oncol. 89: 28–32. 2008. Просмотр статьи: Google Scholar: PubMed / NCBI |
29 | Нг Ш., Чанг Дж. Т., Чан С. К., Ко С. Ф., Ван Х. М., Liao CT, Chang YC и Yen TC: узловые метастазы носоглотки карцинома: картина заболевания на МРТ и ФДГ-ПЭТ. Eur J Nucl Med Mol Imaging. 31: 1073–1080. 2004. Просмотр статьи: Google Scholar: PubMed / NCBI |
30 | Лю LZ, Zhang GY, Xie CM, Liu XW, Cui CY и Li L: Магнитно-резонансная томография заглоточного лимфатического узла. метастазы при раке носоглотки: закономерности распространения.Int J Radiat Oncol Biol Phys. 66: 721–730. 2006. Просмотр статьи: Google Scholar: PubMed / NCBI |
31 | Lv J, Wang R, Qing Y, Du Q и Zhang T: Магнитно-резонансная томография регионарного лимфатического узла метастазирование в 1 298 случаях рака носоглотки. Лин Чунг Эр Би Ян Хоу Тоу Цзин Вай Кэ За Чжи. 26: 769–772. 2012. (на китайском языке). PubMed / NCBI |
32 | Эдж С.Б., Берд Д.Р., Комптон СС, Фриц АГ, Грин Ф.Л. и Тротти А.: Американский объединенный комитет по стадированию рака руководство по эксплуатации.7-е изд. Нью-Йорк: Спрингер; 2009 |
33 | Тан Л.Л., Го Р., Чжоу Г., Сунь И, Лю Л.З., Линь AH, Mai H, Shao J, Li L и Ma J: прогностическая ценность и постановка классификация метастазов в заглоточные лимфатические узлы в Пациенты с раком носоглотки, получавшие лечение с модуляцией интенсивности лучевая терапия. PLoS One. 9: e1083752014. Просмотр статьи: Google Scholar: PubMed / NCBI |
34 | Мао Ю.П., Лян С.Б., Лю Л.З., Чен Ю., Сунь Ю. Тан Л.Л., Тиан Л., Линь А.Х., Лю М.З., Ли Л. и Ма Дж .: Постановка N. система при раке носоглотки при онкологии лучевой терапии групповые рекомендации по уровню лимфатических узлов на основе магнитного резонанса изображения.Clin Cancer Res. 14: 7497–7503. 2008. Просмотр статьи: Google Scholar: PubMed / NCBI |
35 | Лесли С., Мэри Дж. И Крейтианн В.: Международный союз против рака TNM Classification of Malignant Опухоли (7-е изд). 2009. |
36 | Юэ Д., Сюй Ю.Ф., Чжан Ф., Линь Л., Мао Ю.П., Ли WF, Chen L, Sun Y, Liu LZ, Lin AH и др.: Является заменой надключичной ямки с классификацией нижнего уровня на основе Магнитно-резонансная томография полезна при раке носоглотки? Радиотренажер Oncol.113: 108–114. 2014. Просмотр статьи: Google Scholar: PubMed / NCBI |
37 | Ли В.Ф., Сунь Й., Мао Ю.П., Чен Л., Чен Ю.Й., Chen M, Liu LZ, Lin AH, Li L и Ma J: Предлагаемая стадия лимфатических узлов система с использованием Международных рекомендаций по лимфатическим узлам уровни являются прогностическими для пациентов с раком носоглотки от эндемичные районы, обработанные лучевой терапией с модуляцией интенсивности. Int J Radiat Oncol Biol Phys. 86: 249–256. 2013. Просмотр статьи: Google Scholar: PubMed / NCBI |
38 | Вакисака М., Мори Х., Фува Н. и Мацумото A: МР-анализ карциномы носоглотки: корреляция модель распространения опухоли на первичном участке с распределением метастазов в шейные лимфатические узлы.Предварительные результаты. Евро Радиол. 10: 970–977. 2000. Просмотр статьи: Google Scholar: PubMed / NCBI |
39 | Ван XS, Ху CS, Ву YR, Qiu XX и Feng Y: Анализ распределения метастазов на основе компьютерной томографии. шейные узлы в 218 случаях рака носоглотки. Ай Чжэн. 23: 1056–1059. 2004. (на китайском языке). PubMed / NCBI |
40 | Тео П, Шиу В., Люн С.Ф. и Ли В.Й.: Факторы прогноза рака носоглотки, исследованные компьютерная томография — анализ 659 пациентов.Радиотренажер Oncol. 23: 79–93. 1992. Просмотр статьи: Google Scholar: PubMed / NCBI |
41 | Хэн Д.М., Ви Дж., Фонг К.В., Лиан Л.Г., Сетхи ВК, Чуа Э.Т., Ян Т.Л., Тан Кху Х.С., Ли К.С., Ли К.М. и др.: Факторы прогноза у 677 пациентов в Сингапуре с недиссеминированный рак носоглотки. Рак. 86: 1912–1920. 1999. Просмотр статьи: Google Scholar: PubMed / NCBI |
42 | Лю М.З., Тан Л.Л., Цзун Дж.Ф., Хуан Ю., Сунь Ю. Мао Ю.П., Лю Л.З., Линь А.Х. и Ма Дж.: Оценка шестого издания Система стадирования AJCC для карциномы носоглотки и предлагаемая улучшение.Int J Radiat Oncol Biol Phys. 70: 1115–1123. 2008 г. Просмотр статьи: Google Scholar: PubMed / NCBI |
43 | Чэнь Л., Мао Ю.П., Се Ф.Й., Лю Л.З., Сунь Ю. Tian L, Tang LL, Lin AH, Li L и Ma J: седьмое издание Система стадирования UICC / AJCC для карциномы носоглотки прогностически полезен для пациентов, получавших терапию с модуляцией интенсивности лучевая терапия из эндемичного района Китая. Радиотренажер Oncol. 104: 331–337. 2012. Просмотр статьи: Google Scholar: PubMed / NCBI |
44 | Пау Э.Х., Квонг Д.Л., Макмиллан А.С., Вонг М.С., Sham JS, Leung LH и Leung WK: ксеростомия и качество жизни после лучевой терапии с модуляцией интенсивности vs.общепринятый лучевая терапия на ранней стадии карциномы носоглотки: начальная отчет о рандомизированном контролируемом клиническом исследовании. Int J Radiat Oncol Biol Phys. 66: 981–991. 2006. Просмотр статьи: Google Scholar: PubMed / NCBI |
45 | Пэн Г, Ван Т, Ян К.Ю., Чжан С, Чжан Т, Li Q, Han J и Wu G: проспективное рандомизированное исследование, сравнивающее исходы и токсичность лучевой терапии с модуляцией интенсивности vs. обычная двумерная лучевая терапия для лечения рак носоглотки.Радиотренажер Oncol. 104: 286–293. 2012 г. Просмотр статьи: Google Scholar: PubMed / NCBI |
46 | Лай С.З., Ли В.Ф., Чен Л., Ло В., Чен Ю.Ю., Лю LZ, Sun Y, Lin AH, Liu MZ и Ma J: Каким образом модулируется интенсивность лучевая терапия по сравнению с традиционной двумерной лучевой терапией повлиять на результаты лечения карциномы носоглотки пациенты? Int J Radiat Oncol Biol Phys. 80: 661–668. 2011 г. Просмотр статьи: Google Scholar: PubMed / NCBI |
47 | Ли АВМ, Нг В.Т., Чан Л.К., Чан ОШ, Хунг WM, Chan CC, Cheng PTC, Sze H, Lam TS и Yau TK: сила / слабость промежуточной системы AJCC / UICC (7-е издание) для рак носоглотки и предложения по улучшению в будущем.Устный Онкол. 48: 1007–1113. 2012. Просмотр статьи: Google Scholar: PubMed / NCBI |
48 | Zong J, Lin S, Lin J, Tang L, Chen B, Zhang M, Zhang Y, Xu L, Chen Y, Xiao Y и др.: Воздействие Лучевая терапия с модуляцией интенсивности при раке носоглотки: Валидация 7-й редакции промежуточной системы AJCC. |


 00
00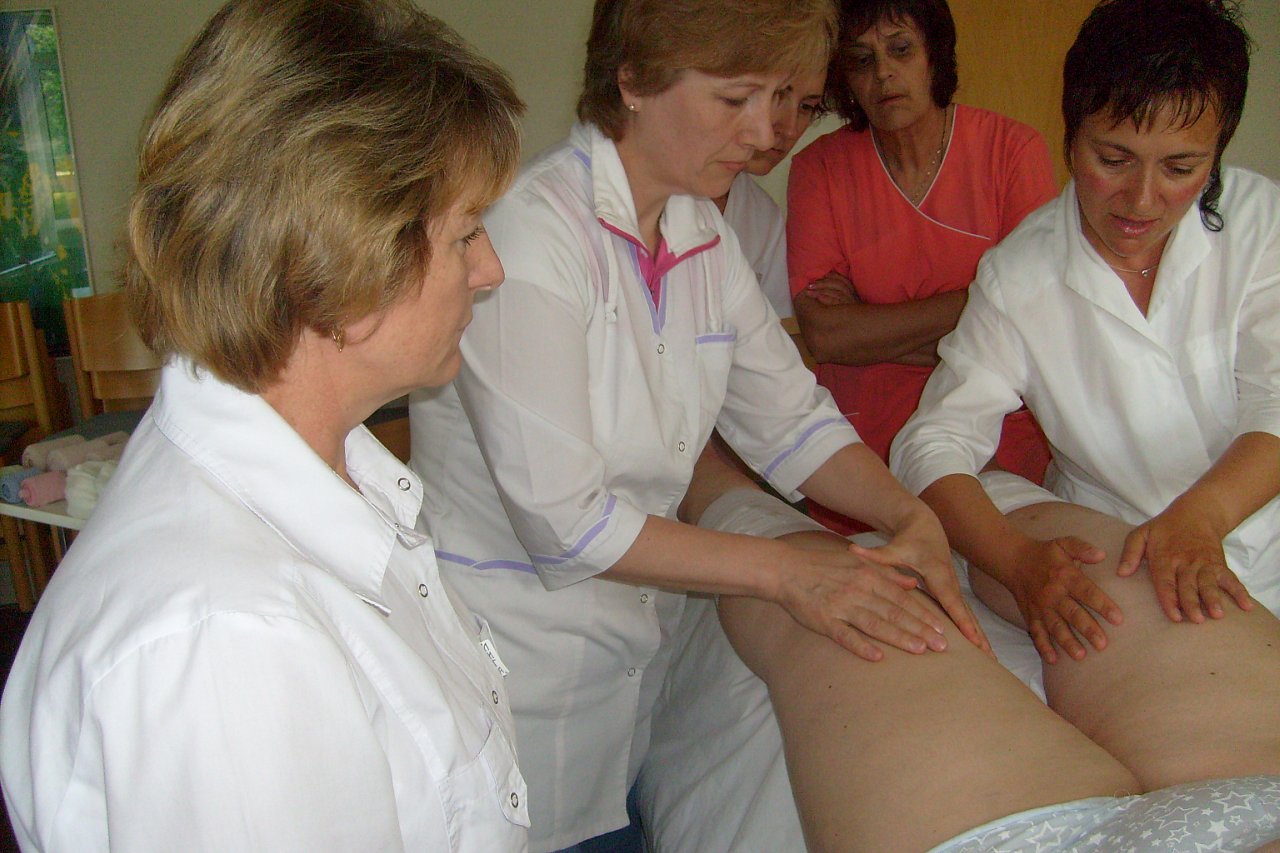 06
06 84
84 55
55 18
18 13
13 )
)
 В любом случае лимфатический узел не превышает 6 см (сантиметров) в поперечнике (N1). Рак не распространился на отдаленные части тела (M0).
В любом случае лимфатический узел не превышает 6 см (сантиметров) в поперечнике (N1). Рак не распространился на отдаленные части тела (M0). ИЛИ, в носоглотке опухоли не обнаружено, но рак обнаружен в лимфатических узлах на шее и является положительным по вирусу Эпштейна-Барра (EBV), что делает его очень вероятным NPC (T0).
ИЛИ, в носоглотке опухоли не обнаружено, но рак обнаружен в лимфатических узлах на шее и является положительным по вирусу Эпштейна-Барра (EBV), что делает его очень вероятным NPC (T0). Рак мог или не мог распространиться на близлежащие лимфатические узлы на шее или за горлом, но ни один из них не был больше 6 см в поперечнике (от N0 до N2).
Рак мог или не мог распространиться на близлежащие лимфатические узлы на шее или за горлом, но ни один из них не был больше 6 см в поперечнике (от N0 до N2). Рак распространился на лимфатические узлы размером более 6 см в поперечнике или расположенные в области плеча чуть выше ключицы (N3).
Рак распространился на лимфатические узлы размером более 6 см в поперечнике или расположенные в области плеча чуть выше ключицы (N3). 4)
4)