Техника взятия смывов | Филиал ФБУЗ «Центр гигиены и эпидемиологии в городе Москве» в ЗАО г. Москвы
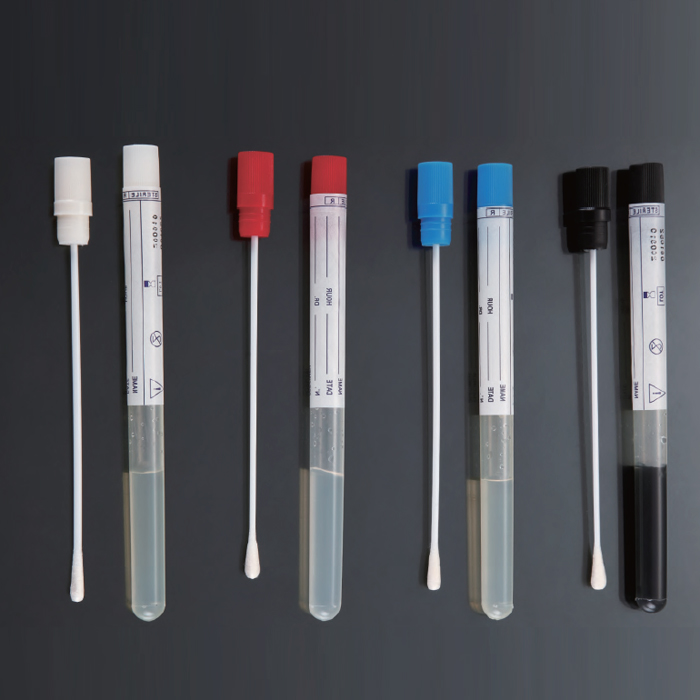
Cмывы с объектов берут тампоном, смоченным в транспортной среде
После взятия смыва тампон помещают обратно в стерильную пробирку
Техника взятия смывов с объектов внешней среды:
- Смывы на микробиологические показатели проводятся не ранее 30 минут после уборки, при закрытых окнах и дверях
- Смывы отбираются в стерильные пробирки с 2 мл транспортной среды
- Ватный тампон, укреплённый на металлическом держателе, находятся в пробирке (до отбора образца тампон не должен касаться жидкости)
- Перед взятием смывов пробирку покачивают, смачивая тампон. Смывы с объектов внешней среды отбираются влажным тампоном. При контроле предметов большой поверхности, смывы отбираются в нескольких местах исследуемого предмета общей площадью 100 см2 (для ограничения поверхности используют шаблон (трафарет) из проволоки или металлических пластин.
 Трафарет, площадью 25 см² накладывают 4 раза в разных местах поверхности контролируемого объекта
Трафарет, площадью 25 см² накладывают 4 раза в разных местах поверхности контролируемого объекта
Техника взятия смывов с рук:
- При взятии смывов с рук – протирают тампоном ладонные поверхности обеих рук, проводя не менее 5 раз по каждой ладони и пальцам, затем протирают межпальцевые пространства, ногти и подногтевые пространства
Техника взятия смывов с санитарной одежды:
- Протирают 4 площадки по 25 см² (нижние части каждого рукава и две площадки с верхней и средней частей передних пол санитарной одежды)
Правила хранения и транспортировки смывов:
- после отбора проб, пробирки в штативе в изотермической сумке, с хладоэлементами доставляются в отдел организации лабораторно-инструментальных исследований (далее – ООЛИИ). В холодное время года контейнеры должны быть снабжены термоизолирующими прокладками, обеспечивающими предохранение проб от промерзания. Прилагается список этикетирования для каждого штатива
- Срок доставки не должен превышать 2 часов
Доставку проб на исследование необходимо осуществлять по адресу:
г. Москва, ул. Вересаева, дом 15, этаж 14, кабинеты № 1406, №1407, отдел организации лабораторно-инструментальных исследований (ООЛИИ) телефон (495) 444-22-67
Москва, ул. Вересаева, дом 15, этаж 14, кабинеты № 1406, №1407, отдел организации лабораторно-инструментальных исследований (ООЛИИ) телефон (495) 444-22-67
И.о. заведующего отделом ООЛИИ – Королихин Павел Александрович
Консультации по лабораторным исследованиям также можно получить в ООЛИИ
Пробирки с тампонами предоставляются после предварительного согласования необходимого количества и даты выдачи с заведующим микробиологической лабораторией (МБЛ)
Заведующий микробиологической лабораторией, телефон (495) 443-49-04
Прием образцов (проб) на лабораторные исследования осуществляется только после предоплаты работ, либо при наличии гарантийного письма
Помните, что в случае нарушения сроков и условий транспортировки проб, возможно искажение достоверности результатов исследования
Протокол отбора проб является обязательным сопроводительным документом, который Вам помогут оформить в ООЛИИ
При заполнении заявления на проведение лабораторных исследований необходимо указать о том, что для отбора проб той или иной продукции, заказчик будет использовать емкости, полученные в Филиале
Контактная информация :
Руководитель ИЛЦ Филиала- заместитель главного врача – Сипко Александр Антонович, телефон (499) 144-32-62
Заведующий микробиологической лабораторией, телефон (495) 443-49-04
Заведующий санитарно-гигиенической лабораторией – Астафьева Елена Теодоровна, телефон (495) 443-78-18
И.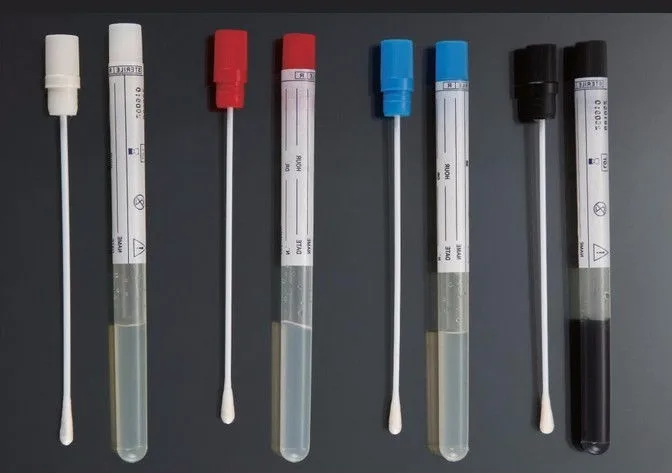
Заведующий отделом организации санитарно-эпидемиологических экспертиз – Рафальская Нина Францевна, телефон (499) 144-32-67
И.о. заведующего отделом коммунальной гигиены – Глаголева Татьяна Борисовна, телефон (499) 144-00-45
- Протокол взятия смывов
- Заявление на лабораторно-инструментальные исследования
- Прейскурант
§ 11. Саннтарно-бактериологический контроль методом исследования смывов
Отбор проб и доставка в лабораторию
В практике текущего санитарного надзора
за объектами общественного питания,
торговой сети, пищеблоками детских
дошкольных и подростковых учреждений,
а также буфетами — раздаточными
лечебно-профилактических учреждений
широко используется метод смывов с
целью контроля эффективности санитарной
обработки инвентаря, оборудования,
посуды, санитарной одежды и рук персонала.
При проведении санитарно-бактериологических исследований смывов в основном ограничиваются выявлением бактерий группы кишечной палочки, обнаружение их расценивается как одно из подтверждений нарушения санитарного режима.
При выявлении вторичного массивного обсеменения готового продукта со значительным превышением в нем общего количества микробов, в смывах также необходимо определять общую бактериальную обсемененность и наличие бактерий рода Proteus и St. aureus.
При взятии смывов с оборудования, инвентаря, посуды, столовых приборов записывается: номер образца по порядку, место взятия смыва, в каком техническом и санитарном состоянии находилось оборудование (инвентарь, посуда и т. д.), с которого взят смыв, время забора.
При взятии смывов с рук записывается:
номер по порядку, фамилия, имя и отчество
сотрудника, выполняемая работа, время
забора.
Доставка проб должна производиться в термоконтейнерах.
Время доставки проб продуктов и смывов в лаборатории для осуществления исследования не должно превышать двух часов, так как затягивание этого срока отражается на достоверности результатов анализа.
Техника взятия смывов
Взятие смывов производится с помощью стерильных увлажненных ватных тампонов. Стерильные ватные тампоны на стеклянных, металлических или деревянных палочках, вмонтированных в пробирки с ватными пробками, заготавливают заранее в лаборатории. В день взятия смывов в каждую пробирку с тампоном наливают (в условиях бокса над горелкой) по 5 мл стерильного 0,1% водного раствора пептона таким образом, чтобы ватный тампон не касался жидкости.
Непосредственно перед взятием смыва тампон увлажняют средой.
Смывы с крупного оборудования и инвентаря
берут с поверхности 100 см2, для ограничения
поверхностей используют шаблон
(трафарет), сделанный из проволоки.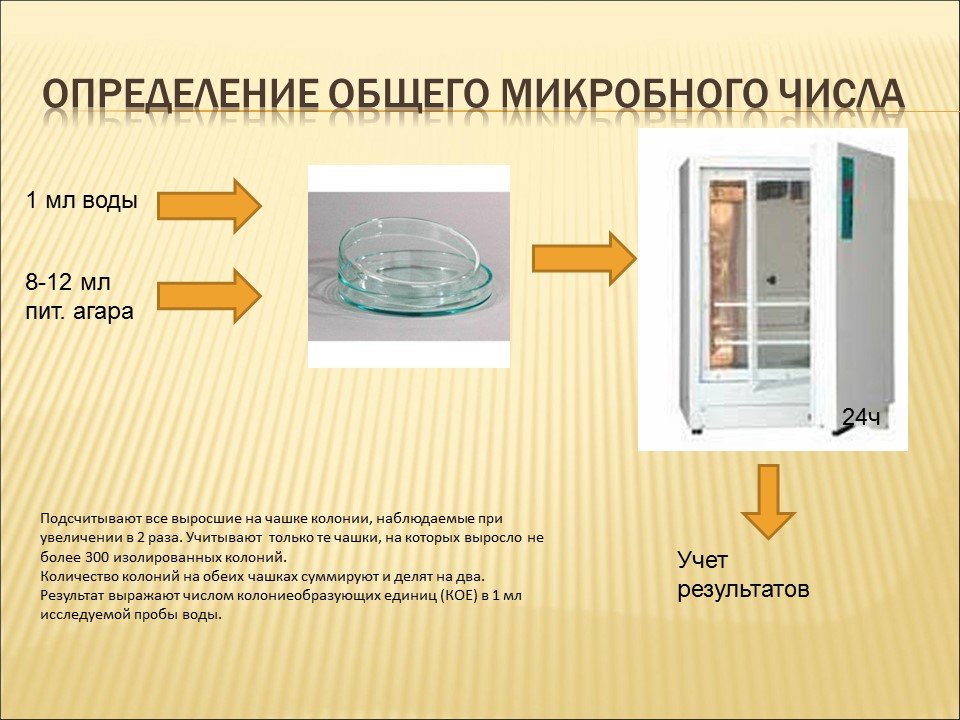 Трафарет имеет площадь 25 см2, чтобы взять
смывы с площади в 100 см2 его накладывают
4 раза в разных местах поверхности
контролируемого объекта.
Трафарет имеет площадь 25 см2, чтобы взять
смывы с площади в 100 см2 его накладывают
4 раза в разных местах поверхности
контролируемого объекта.
При взятии смывов с мелких инструментов обтирается вся поверхность предмета, при заборе смывов с тарелок протирают всю внутреннюю поверхность. При взятии смывов с мелких предметов одним тампоном протирают три одноименных объекта— три тарелки, три ложки и т. п. У столовых приборов протирают их рабочую часть.
При исследовании стаканов протирают внутреннюю поверхность и верхний наружный край стакана на 2 см вниз.
При взятии смывов с рук протирают тампоном ладонные поверхности обеих рук, проводя не менее 5 раз по каждой ладони и пальцам, затем протирают межпальцевые пространства.

Методика исследования смывов. Объем исследования
На предприятиях общественного питания исследование смывов проводят на присутствие бактерий группы кишечных палочек.
Исследование на наличие золотистого стафилококка и протея, определение общей бактериальной обсемененности производится по показаниям.
Например:
Методика посева смывов на бактерии группы кишечных палочек
При плановых санитарно-гигиенических
обследованиях для выявления БГКП
производят посевы смывов на среды
Кесслера с лактозой или Кода, при этом
в пробирку со средой опускают тампон и
переносят оставшуюся смывную жидкость.
Посевы на средах Кесслера или Кода инкубируют при 37°С, через 18—24 часа со среды Кесслера производят высев на плотную дифференциальную среду Эндо, со среды Кода высев производят в случае изменения окраски среды или ее помутнения.
Посевы помещают в термостат при температуре 37 °С на 24 часа, после чего просматривают. Из колоний, подозрительных или типичных для БГКП, готовят мазки, окрашивают по Граму и микроскопируют. Обнаружение грамотри-цательных палочек указывает на наличие БГКП.
Методика посева на общую бактериальную обсемененность
Перед посевом смывов в пробирку с
тампоном добавляют 5 мл 0,1% пептонной
воды или изотонического раствора хлорида
натрия. Тампон тщательно отмывают, после
чего 1,0 мл смывной жидкости помещают в
чашку Петри и заливают расплавленным
МПА. Чашки помещают в термостат при
30°С. Предварительный подсчет выросших
колоний производят через 48 часов,
окончательный — через 72 часа. Количество
колоний, выросших на чашке, умножают на
10 для определения общего количества
бактерий, содержащихся на поверхности
исследуемого предмета.
Количество
колоний, выросших на чашке, умножают на
10 для определения общего количества
бактерий, содержащихся на поверхности
исследуемого предмета.
Методика посева на золотистый стафилококк
Для выявления золотистого стафилококка посев смывов производят на чашки с желточно-солевым агаром, непосредственно втирая посевной материал тампоном, затем последний погружают в пробирку с 6,5% солевым бульоном.
Оценка результатов
Обнаружение санитарно-показательных и условно-патогенных бактерий в смывах с поверхностей чистых, подготовленных к работе предметов, инвентаря и оборудования, а также рук персонала свидетельствует о нарушении санитарного режима и дает основание для проведения административных мер.
Загрязнение поверхностей больниц бактериальными патогенами при текущей вспышке COVID-19
1. Chen X., Chen Z., Azman A.S., Sun R., Lu W., Zheng N., Zhou J., Wu Q., Дэн X., Чжао З. и др. Нейтрализующие антитела против вариантов SARS-CoV-2, вызванных естественной инфекцией или вакцинацией: систематический обзор и объединенный метаанализ. клин. Заразить. Дис. 2021 г.: 10.1093/cid/ciab646. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
клин. Заразить. Дис. 2021 г.: 10.1093/cid/ciab646. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
2. Harvey W.T., Carabelli A.M., Jackson B., Gupta R.K., Thomson E.C., Harrison E.M., Ludden C., Reeve R., Rambaut A., Пикок С.Дж. и др. Варианты SARS-CoV-2, спайковые мутации и ускользание от иммунитета. Нац. Преподобный Микробиолог. 2021;19: 409–424. doi: 10.1038/s41579-021-00573-0. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
3. Аленкер М., Феррейра Ф., Луза Д., Валерио М., Медина-Лопес М., Бергман М.-Л., Гонсалвеш Дж. ., Demengeot J., Leite R.B., Lilue J., et al. Сигнатуры шиповидного белка SARS-CoV-2, обеспечивающие ускользание от нейтрализующих антител. PLoS Патог. 2021;17:e1009772. doi: 10.1371/journal.ppat.1009772. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
4. Ghinai I., McPherson T.D., Hunter J.C., Kirking HL, Christiansen D., Joshi K., Rubin R., Morales-Estrada S., Блэк С.Р., Пачилли М. и соавт. Первая известная передача от человека к человеку коронавируса тяжелого острого респираторного синдрома 2 (SARS-CoV-2) в США. Ланцет. 2020;395:1137–1144. doi: 10.1016/S0140-6736(20)30607-3. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Ланцет. 2020;395:1137–1144. doi: 10.1016/S0140-6736(20)30607-3. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
5. Pastorino B., Touret F., Gilles M., de Lamballerie X., Charrel R.N. Длительная инфекционность SARS-CoV-2 в фомитах. Эмердж. Заразить. Дис. 2020;26:2256–2257. doi: 10.3201/eid2609.201788. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
6. Peng X., Xu X., Li Y., Cheng L., Zhou X., Ren B. Пути передачи 2019-nCoV и контроль в стоматологической практике. Междунар. Дж. Устные науки. 2020; 12:1–6. doi: 10.1038/s41368-020-0075-9. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
7. Ричард М., Кок А., де Меулдер Д., Бестеброер Т.М., Ламерс М.М., Окба Н.М.А., Фентенер ван Флиссинген М., Роккс Б. , Haagmans B.L., Koopmans M.P.G., et al. SARS-CoV-2 передается через контакт и по воздуху между хорьками. Нац. коммун. 2020;11:3496. doi: 10.1038/s41467-020-17367-2. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
8. Ong S.W.X., Tan Y.K., Chia P.Y., Lee TH, Ng O.T., Wong M.S.Y., Marimuthu K. Загрязнение воздуха, поверхности и средств индивидуальной защиты от тяжелого острого респираторного синдрома Коронавирус 2 (SARS-CoV-2) от пациента с симптомами. Варенье. Мед. доц. 2020;323:1610–1612. doi: 10.1001/jama.2020.3227. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Ong S.W.X., Tan Y.K., Chia P.Y., Lee TH, Ng O.T., Wong M.S.Y., Marimuthu K. Загрязнение воздуха, поверхности и средств индивидуальной защиты от тяжелого острого респираторного синдрома Коронавирус 2 (SARS-CoV-2) от пациента с симптомами. Варенье. Мед. доц. 2020;323:1610–1612. doi: 10.1001/jama.2020.3227. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
9. Ван Ю., Цяо Ф., Чжоу Ф., Юань Ю. Аэрозольное и поверхностное распространение тяжелого острого респираторного синдрома Коронавируса 2 в больничных палатах, Ухань, Китай, 2020 г. Внутренняя застроенная среда. 2020; 26: 1586–1591. doi: 10.3201/eid2607.200885. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
10. Ниссен К., Крамбрих Дж., Акабери Д., Хоффман Т., Линг Дж., Лундквист А., Свенссон Л., Саланек Э. Распространение SARS-CoV-2 по воздуху на большие расстояния в отделениях COVID-19. науч. 2020;10:19589. doi: 10.1038/s41598-020-76442-2. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, и другие. Аэрозольное и поверхностное заражение SARS-CoV-2 наблюдается в условиях карантина и изоляции. науч. 2020; 10:12732. doi: 10.1038/s41598-020-69286-3. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Аэрозольное и поверхностное заражение SARS-CoV-2 наблюдается в условиях карантина и изоляции. науч. 2020; 10:12732. doi: 10.1038/s41598-020-69286-3. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
12. Liu Y., Ning Z., Chen Y., Guo M., Liu Y., Gali N.K., Sun L., Duan Y., Кай Дж., Вестердал Д. и соавт. Аэродинамический анализ SARS-CoV-2 в двух больницах Уханя. Природа. 2020; 582: 557–560. doi: 10.1038/s41586-020-2271-3. [PubMed] [CrossRef] [Академия Google]
13. Барди Т., Пинтадо В., Гомес-рохо М., Эскудеро-санчес Р., Лопес А.А. Внутрибольничные инфекции, связанные с COVID-19, в отделении интенсивной терапии: клинические характеристики и исход. Евро. Дж. Клин. микробиол. Заразить. Дис. 2021: 495–502. doi: 10.1007/s10096-020-04142-w. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, и другие. Коинфекция SARS-CoV-2 и другими респираторными патогенами у пациентов с COVID-19в Гуанчжоу, Китай. Дж. Мед. Вирол. 2020;92:2381–2383. doi: 10.1002/jmv. 26073. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
26073. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
15. He S., Liu W., Jiang M., Huang P., Xiang Z., Deng D., Chen P., Xie L. Клинические характеристики пациентов с COVID-19 с клинически диагностированной бактериальной коинфекцией: многоцентровое исследование. ПЛОС ОДИН. 2021;16:e0249668. doi: 10.1371/journal.pone.0249668. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
16. Langford B.J., So M., Raybardhan S., Leung V., Westwood D., MacFadden D.R., Soucy J.P.R., Daneman N. Bacterial co- инфекция и вторичная инфекция у пациентов с COVID-19: живой быстрый обзор и метаанализ. клин. микробиол. Заразить. 2020; 26: 1622–1629. doi: 10.1016/j.cmi.2020.07.016. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
17. Lai C.C., Wang C.Y., Hsueh P.R. Коинфекции среди пациентов с COVID-19: необходимость комбинированной терапии с неанти-SARS-CoV -2 агента? Дж. Микробиол. Иммунол. Заразить. 2020; 53: 505–512. doi: 10.1016/j.jmii.2020.05.013. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
18. Аркари Г., Рапони Г., Сакко Ф., Бибболино Г., Ди Лелла Ф.М., Алессандри Ф., Колетти М., Транкассини М. , Deales A., Pugliese F., et al. Инфекции Klebsiella pneumoniae у пациентов с COVID-19: двухмесячный ретроспективный анализ в итальянской больнице. Междунар. Дж. Антимикроб. Агенты. 2021;57:106245. doi: 10.1016/j.ijantimicag.2020.106245. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Аркари Г., Рапони Г., Сакко Ф., Бибболино Г., Ди Лелла Ф.М., Алессандри Ф., Колетти М., Транкассини М. , Deales A., Pugliese F., et al. Инфекции Klebsiella pneumoniae у пациентов с COVID-19: двухмесячный ретроспективный анализ в итальянской больнице. Междунар. Дж. Антимикроб. Агенты. 2021;57:106245. doi: 10.1016/j.ijantimicag.2020.106245. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
19. Кусумано Дж.А., Дуппер А.С., Малик Ю., Гавиоли Э.М., Банга Дж., Бербель Кабан А., Надкарни Д., Обла А., Васа C.V., Mazo D. и соавт. Staphylococcus aureus Бактериемия у пациентов, инфицированных COVID-19: серия случаев. Откройте форум Infect. Дис. 2020;7:5–11. дои: 10.1093/ofid/ofaa518. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
20. Русич Д., Вилович М., Букич Ю., Лескур Д., Сеселя Перишин А., Кумрич М., Мартинович Д., Петрич А. ., Modun D., Bozic J. Последствия пандемии COVID-19 для возникновения устойчивости к противомикробным препаратам: корректировка реагирования на будущие вспышки. Жизнь. 2021;11:220. doi: 10.3390/life11030220. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Жизнь. 2021;11:220. doi: 10.3390/life11030220. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
21. Kramer A., Schwebke I., Kampf G. Как долго внутрибольничные патогены сохраняются на неживых поверхностях? Систематический обзор. Заражение BMC. Дис. 2006; 6:130. дои: 10.1186/1471-2334-6-130. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
22. Бхатта Д.Р., Хамал Д., Шреста Р., Хосуру Субраманья С., Барал Н., Сингх Р.К., Наяк Н., Гокхале С. Бактериальное заражение предметов, к которым часто прикасаются, в больнице третичного уровня в Покхаре, Непал: Насколько безопасны наши руки? Антимикроб. Сопротивляться. Заразить. Контроль. 2018;7:4–9. doi: 10.1186/s13756-018-0385-2. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
23. Ван Бик Дж., де Грааф М., Аль-Хелло Х., Аллен Д.Дж., Амберт-Балай К., Боттелдорн Н., Бриттинг М. ., Buesa J., Cabrerizo M., Chan M., et al. Молекулярный надзор за норовирусом, 2005–2016 гг.: эпидемиологический анализ данных, собранных в сети NoroNet. Ланцет Инфекция. Дис. 2018;18:545–553. дои: 10.1016/S1473-3099(18)30059-8. [PubMed] [CrossRef] [Google Scholar]
Ланцет Инфекция. Дис. 2018;18:545–553. дои: 10.1016/S1473-3099(18)30059-8. [PubMed] [CrossRef] [Google Scholar]
24. Desdouits M., de Graaf M., Strubbia S., Oude Munnink B.B., Kroneman A., Le Guyader F.S., Koopmans M.P.G. Новые возможности для эпиднадзора за вирусами пищевого происхождения на основе NGS. Один взгляд на здоровье. 2020; 2 doi: 10.1186/s42522-020-00015-6. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
25. Rampelotto PH, Sereia AFR, De Oliveira L.F.V., Margis R. Изучение микробиома больницы с помощью профилирования 16s рРНК с высоким разрешением. Междунар. Дж. Мол. науч. 2019;20:3099. doi: 10.3390/ijms20123099. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
26. Почтовый А.А., Бакалин В.В., Кузнецова Н.А., Никифорова М.А., Шидловская Е.В., Вердиев Б.И., Милащенко Е.Н., Щетинин А.М., Бургасова О.А., Колобухина Л.В. др. Аэрозольное и поверхностное загрязнение SARS-CoV-2 в медицинских учреждениях: экспериментальное исследование в Москве. Аэрозоль Эйр Квал. Рез. 2021;21:200604. doi: 10.4209/aaqr.200604. [CrossRef] [Google Scholar]
Аэрозоль Эйр Квал. Рез. 2021;21:200604. doi: 10.4209/aaqr.200604. [CrossRef] [Google Scholar]
27. Chia P.Y., Coleman K.K., Tan Y.K., Ong S.W.X., Gum M., Lau S.K., Lim X.F., Lim A.S., Sutjipto S., Lee P.H., et al. Выявление загрязнения воздуха и поверхностей SARS-CoV-2 в больничных палатах инфицированных пациентов. Нац. коммун. 2020;11:2800. doi: 10.1038/s41467-020-16670-2. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
28. Хемати С., Мобини Г.Р., Хейдари М., Рахмани Ф., Солеймани Бабади А., Фархадхани М., Нурморади Х., Раиси А., Ахмади А., Ходабахши А. и др. Одновременный мониторинг SARS-CoV-2, бактерий и грибков в воздухе помещений больницы: исследование больницы Хаджар в Шахрекорде, Иран. Окружающая среда. науч. Загрязн. Рез. 2021 г.: 10.1007/s11356-021-13628-9. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
29. Хассан М.З., Штурм-Рамирез К., Рахман М.З., Хоссейн К., Алим М.А., Бхуйян М.У., Ислам М.М., Рахман М., Герли Э.С. Загрязнение больничных поверхностей респираторными патогенами в Бангладеш. ПЛОС ОДИН. 2019;14:e0224065. doi: 10.1371/journal.pone.0224065. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
ПЛОС ОДИН. 2019;14:e0224065. doi: 10.1371/journal.pone.0224065. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
30. Прайс Э.П., Аранго В.С., Кидд Т.Дж., Фрейзер Т.А., Нгуен Т.К., Белл С.К., Сарович Д.С. Дуплексный анализ ПЦР в реальном времени для одновременного обнаружения Achromobacter xylosoxidans и Achromobacter spp. микроб. Геном. 2020; 6:1–11. doi: 10.1099/mgen.0.000406. [Статья PMC бесплатно] [PubMed] [CrossRef] [Google Scholar]
31. Deschaght P., De Baere T., Van Simaey L., Van Daele S., De Baets F., De Vos D., Pirnay J.P. , Vaneechoutte M. Сравнение чувствительности культуры, ПЦР и количественной ПЦР в реальном времени для обнаружения Pseudomonas aeruginosa в мокроте больных муковисцидозом. БМС микробиол. 2009;9:244. дои: 10.1186/1471-2180-9-244. [ЧВК бесплатная статья] [PubMed] [CrossRef] [Google Scholar]
32. Martinucci M., Roscetto E., Iula V.D., Votsi A., Catania M.R., De Gregorio E. Точная идентификация членов Burkholderia cepacia Комплекс в муковисцидозной мокроте. лат. заявл. микробиол. 2016;62:221–229. doi: 10.1111/lam.12537. [PubMed] [CrossRef] [Академия Google]
лат. заявл. микробиол. 2016;62:221–229. doi: 10.1111/lam.12537. [PubMed] [CrossRef] [Академия Google]
33. Хартман Л.Дж., Селби Э.Б., Уайтхаус К.А., Койн С.Р., Джейссл Дж.Г., Твенхафель Н.А., Берк Р.Л., Кулеш Д.А. Быстрые анализы ПЦР в реальном времени для обнаружения Klebsiella pneumoniae с генами rmpA или magA, связанными с фенотипом повышенной слизистой вязкости: скрининг нечеловекообразных приматов. Дж. Мол. Диагн. 2009; 11: 464–471. doi: 10.2353/jmoldx.2009.080136. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
34. Caporaso J.G., Lauber C.L., Walters W.A., Berg-Lyons D., Lozupone C.A., Turnbaugh P.J., Fierer N., Knight R. Разнообразие 16S рРНК на глубине в миллионы последовательностей на образец. проц. Натл. акад. науч. США. 2011;108:4516–4522. doi: 10.1073/pnas.1000080107. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
35. Дэвис Н.М., Проктор Д.М., Холмс С.П., Релман Д.А., Каллахан Б.Дж. Простая статистическая идентификация и удаление загрязняющих последовательностей в данных маркерного гена и метагеномики. Микробиом. 2018; 6:1–39. doi: 10.1186/s40168-018-0605-2. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Микробиом. 2018; 6:1–39. doi: 10.1186/s40168-018-0605-2. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
36. Quast C., Pruesse E., Yilmaz P., Gerken J., Schweer T., Yarza P., Peplies J., Glöckner F.O. Проект базы данных генов рибосомной РНК SILVA: улучшенная обработка данных и веб-инструменты. Нуклеиновые Кислоты Res. 2013;41:590–596. doi: 10.1093/nar/gks1219. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
37. McMurdie P.J., Holmes S. Phyloseq: пакет R для воспроизводимого интерактивного анализа и графики данных переписи микробиома. ПЛОС ОДИН. 2013;8:e61217. doi: 10.1371/journal.pone.0061217. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
38. Ван Д., Ху Б., Ху С., Чжу Ф., Лю С., Чжан Дж., Ван Б., Сян Х. , Ченг З., Сюн Ю. и др. Клиническая характеристика 138 госпитализированных пациентов с 2019 г.Новая коронавирусная пневмония в Ухане, Китай. Варенье. Мед. доц. 2020;323:1061–1069. doi: 10.1001/jama.2020.1585. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
39. Люсьен М.А.Б., Канари М.Ф., Килгор П.Е., Жан-Дени Г., Фенелон Н., Пьер М., Серпа М., Джозеф Г.А., Маки Г., Зервос М.Дж. и соавт. Антибиотики и устойчивость к противомикробным препаратам в эпоху COVID-19: точка зрения в условиях ограниченных ресурсов. Междунар. Дж. Заразить. Дис. 2021; 104: 250–254. doi: 10.1016/j.ijid.2020.12.087. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Люсьен М.А.Б., Канари М.Ф., Килгор П.Е., Жан-Дени Г., Фенелон Н., Пьер М., Серпа М., Джозеф Г.А., Маки Г., Зервос М.Дж. и соавт. Антибиотики и устойчивость к противомикробным препаратам в эпоху COVID-19: точка зрения в условиях ограниченных ресурсов. Междунар. Дж. Заразить. Дис. 2021; 104: 250–254. doi: 10.1016/j.ijid.2020.12.087. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
40. Лэнгфорд Б.Дж., Со М., Райбардхан С., Леунг В., Суси Дж.П.Р., Вествуд Д., Данеман Н., Макфадден Д.Р. Назначение антибиотиков пациентам с COVID-19: экспресс-обзор и метаанализ. клин. микробиол. Заразить. 2021; 27: 520–531. doi: 10.1016/j.cmi.2020.12.018. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
41. Becker K., Heilmann C., Peters G. Коагулазоотрицательные стафилококки. клин. микробиол. 2014; 27:870–926. doi: 10.1128/CMR.00109-13. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
42. Пенья К., Пухоль М., Ардануи К., Рикарт А., Палларес Р., Линьярес Дж. , Ариса Дж., Гудиол Ф. Вспышка внутрибольничной Klebsiella pneumoniae бактериемии, включая штаммы, продуцирующие бета-лактамазы расширенного спектра действия. Дж. Хосп. Заразить. 2001; 47: 53–59. doi: 10.1053/jhin.2000.0862. [PubMed] [CrossRef] [Google Scholar]
, Ариса Дж., Гудиол Ф. Вспышка внутрибольничной Klebsiella pneumoniae бактериемии, включая штаммы, продуцирующие бета-лактамазы расширенного спектра действия. Дж. Хосп. Заразить. 2001; 47: 53–59. doi: 10.1053/jhin.2000.0862. [PubMed] [CrossRef] [Google Scholar]
43. Хосода Т., Харада С., Окамото К., Ишино С., Канеко М., Судзуки М., Ито Р., Мидзогути М. COVID-19 и летальный исход сепсис, вызванный гипервирулентным Klebsiella pneumoniae , Япония, 2020 г. Заразить. Дис. 2021; 27: 556–559. doi: 10.3201/eid2702.204662. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
44. Choudhury S., Papineni S., Ramachandruni S., Molina J., Surani S. Achromobacter xylosoxidans /denitrificans Бактеремия у пациента с болезнью Гуда Синдром. Куреус. 2021; 13:11–15. doi: 10.7759/cureus.13827. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
45. Awadh H., Mansour M., Aqtash O., Shweihat Y. Пневмония, вызванная редким патогеном: Achromobacter xylosoxidans , подвид denitrificans.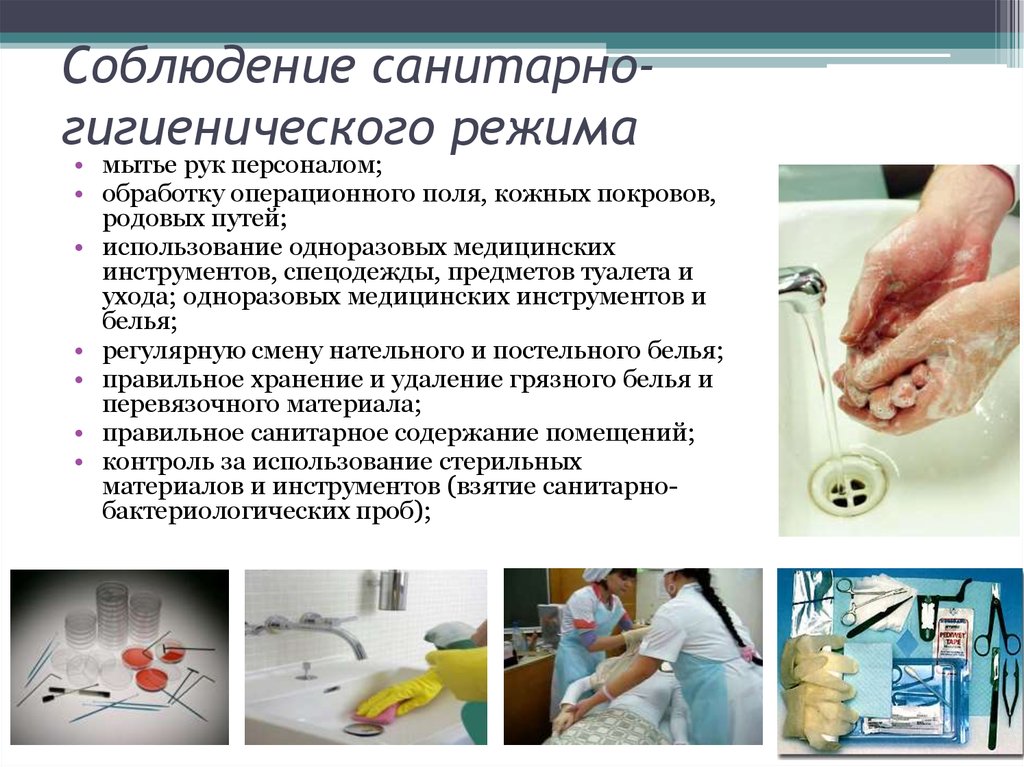 Представитель по делу Infect. Дис. 2017;2017:1–4. doi: 10.1155/2017/3969682. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Представитель по делу Infect. Дис. 2017;2017:1–4. doi: 10.1155/2017/3969682. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
46. Осман Х., Нгуен П. Первый случай COVID-19, осложненный пневмонией и бактериемией Burkolderia Cepacia. Грудь. 2020;158:A544. doi: 10.1016/j.chest.2020.08.514. [CrossRef] [Google Scholar]
47. Zhong H., Wang Y., Shi Z., Zhang L., Ren H., He W., Zhang Z., Zhu A., Zhao J., Xiao F. , и другие. Характеристика респираторного микробного дисбактериоза у госпитализированных с COVID-19пациенты. Сотовый Дисков. 2021;7 doi: 10.1038/s41421-021-00257-2. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
48. Sirivongrangson P., Kulvichit W., Payungporn S., Pisitkun T., Chindamporn A., Peerapornratana S., Pisitkun P., Chitcharoen S. , Sawaswong V., Worasilchai N., et al. Эндотоксемия и циркулирующий бактериом у пациентов с тяжелым течением COVID-19. Интенсивная терапия Мед. Эксп. 2020;8 doi: 10.1186/s40635-020-00362-8. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
49. Росас-Салазар К., Кимура К.С., Шилтс М.Х., Стрикленд Б.А., Фримен М.Х., Вессингер Б.К., Гупта В., Браун Х.М., Раджагопала С.В., Тернер Дж.Х. и др. Инфекция SARS-CoV-2 и вирусная нагрузка связаны с микробиомом верхних дыхательных путей. Дж. Аллергия Клин. Иммунол. 2021;147:1226–1233.e2. doi: 10.1016/j.jaci.2021.02.001. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Росас-Салазар К., Кимура К.С., Шилтс М.Х., Стрикленд Б.А., Фримен М.Х., Вессингер Б.К., Гупта В., Браун Х.М., Раджагопала С.В., Тернер Дж.Х. и др. Инфекция SARS-CoV-2 и вирусная нагрузка связаны с микробиомом верхних дыхательных путей. Дж. Аллергия Клин. Иммунол. 2021;147:1226–1233.e2. doi: 10.1016/j.jaci.2021.02.001. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
50. Ma S., Zhang F., Zhou F., Li H., Ge W., Gan R., Nie H., Li B. , Ван Ю., Ву М. и др. Метагеномный анализ выявил изменения ротоглоточной микробиоты у пациентов с COVID-19. Сигнальный преобразователь. Цель. тер. 2021;6 doi: 10.1038/s41392-021-00614-3. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
51. Oie S., Hosokawa I., Kamiya A. Загрязнение дверных ручек комнат чувствительными к метициллину/резистентными к метициллину штаммами Staphylococcus aureus . Дж. Хосп. Заразить. 2002; 51: 140–143. doi: 10.1053/jhin.2002.1221. [PubMed] [CrossRef] [Google Scholar]
52. Caneiras C., Lito L., Melo-Cristino J., Duarte A. Внебольничная и внутрибольничная инфекция Klebsiella pneumoniae инфекции мочевыводящих путей в Португалии: вирулентность и устойчивость к антибиотикам. Микроорганизмы. 2019;7:138. doi: 10.3390/микроорганизмы7050138. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Caneiras C., Lito L., Melo-Cristino J., Duarte A. Внебольничная и внутрибольничная инфекция Klebsiella pneumoniae инфекции мочевыводящих путей в Португалии: вирулентность и устойчивость к антибиотикам. Микроорганизмы. 2019;7:138. doi: 10.3390/микроорганизмы7050138. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
53. Engelhart S.T., Krizek L., Glasmacher A., Fischnaller E., Marklein G., Exner M. Pseudomonas aeruginosa вспышка в гематологии- онкологическое отделение, связанное с загрязненным оборудованием для очистки поверхностей. Дж. Хосп. Заразить. 2002; 52: 93–98. doi: 10.1053/jhin.2002.1279. [PubMed] [CrossRef] [Академия Google]
54. Нкуви Э.Дж., Кабананги Ф., Иоахим А., Ругарабаму С., Маджиго М. Метициллин-резистентный штамм Staphylococcus aureus и распространение в среде ухода за пациентами в Национальной больнице Мухимбили, Дар-эс-Салам, Танзания. BMC Res. Заметки. 2018;11:4–9. doi: 10.1186/s13104-018-3602-4. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
55. Де Абреу П.М., Фариас П.Г., Пайва Г.С., Алмейда А.М., Мораис П.В. Устойчивость микробных сообществ, в том числе Pseudomonas aeruginosa в условиях больницы: потенциальная опасность для здоровья. БМС микробиол. 2014;14:118. дои: 10.1186/1471-2180-14-118. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
Де Абреу П.М., Фариас П.Г., Пайва Г.С., Алмейда А.М., Мораис П.В. Устойчивость микробных сообществ, в том числе Pseudomonas aeruginosa в условиях больницы: потенциальная опасность для здоровья. БМС микробиол. 2014;14:118. дои: 10.1186/1471-2180-14-118. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
Мониторинг окружающей среды может снизить заболеваемость инфекциями, связанными с оказанием медицинской помощи (HAI)
Согласно данным, собранным Центрами по контролю и профилактике заболеваний (CDC), примерно 1 из 31 (3,2%) пациентов больниц в США заражаются инфекциями, связанными с оказанием медицинской помощи (HAI). Это составляет примерно 2 миллиона внутрибольничных инфекций в год в США, что приводит к
смертей и затраты больниц, Medicare/Medicaid, поставщиков медицинского страхования и пациентов на сумму от 28 до 45 миллиардов долларов.
Пациенты в медицинских учреждениях часто особенно уязвимы к инфекциям из-за ослабленной иммунной системы и наличия инвазивных медицинских устройств, таких как иглы и катетеры. Двумя распространенными и особенно опасными причинами ИСМП являются устойчивый к метициллину Staphylococcus aureus (MRSA) и Clostridioides difficile ( C. diff ).
Двумя распространенными и особенно опасными причинами ИСМП являются устойчивый к метициллину Staphylococcus aureus (MRSA) и Clostridioides difficile ( C. diff ).
C. diff и MRSA как ИСМП
C. diff представляет собой уникальную проблему, поскольку ее трудно устранить путем очистки, и она часто возникает у пациентов сразу после курса лечения антибиотиками. Кроме того, вне организма бактерия образует споры. Эти споры трудно удалить, что затрудняет восстановление C. diff . CDC оценивает C. diff . приходится 15 000 из 90 000 смертей, связанных с HAI каждый год.
MRSA — еще одна вызывающая беспокойство бактерия, часто встречающаяся в медицинских учреждениях. Организм может выжить на нетипичных поверхностях, таких как полотенца, мебель и бритвы. Устойчивая к антибиотикам природа MRSA делает лечение инфекции проблематичным.
CDC считает
C. auris «глобальной новой угрозой» Растущую озабоченность в медицинских учреждениях вызывает смертельный (по оценкам, смертность составляет 40%), полирезистентный грибок Candida auris ( C. auris ). По состоянию на 30 апреля эпиднадзор CDC сообщает о 684 случаях внутрибольничной инфекции C. auris в США в 2019 году. Пациенты, подключенные к трубкам или трубкам, особенно восприимчивы к этим трудно убиваемым дрожжевым грибкам. Как и MRSA , C. auris может выживать и развиваться как на твердых, так и на мягких поверхностях, включая кожу человека, что повышает вероятность передачи инфекции от пациента к пациенту.
auris ). По состоянию на 30 апреля эпиднадзор CDC сообщает о 684 случаях внутрибольничной инфекции C. auris в США в 2019 году. Пациенты, подключенные к трубкам или трубкам, особенно восприимчивы к этим трудно убиваемым дрожжевым грибкам. Как и MRSA , C. auris может выживать и развиваться как на твердых, так и на мягких поверхностях, включая кожу человека, что повышает вероятность передачи инфекции от пациента к пациенту.
План предотвращения ИСМП в больницах
Больничные палаты представляют собой сложную среду для инфекционного контроля из-за различных типов поверхностей, подлежащих очистке и дезинфекции. Для нескольких поверхностей (текстиль, подушки, дерево и металл) могут потребоваться разные дезинфицирующие средства и чистящие средства. Например, дезинфицирующие средства на основе отбеливателя смертельны для некоторых из самых стойких организмов. Однако хлор повреждает мягкие пористые поверхности, такие как покрывала и матрасы, и вызывает коррозию нержавеющей стали.
Добавьте к этому необходимость быстро освободить палаты для новых пациентов, и этот процесс приведет к неадекватной уборке. Быстрая оборачиваемость также не оставляет времени на проверку процедуры очистки.
В отчете CDC, опубликованном как часть Инструментария по предотвращению ИСМП, озаглавленного «Варианты оценки очистки окружающей среды», говорится: «Всем больницам рекомендуется разрабатывать программы для оптимизации тщательности очистки поверхностей с высокой степенью касания в рамках уборки палат терминала в больнице. время выписки или перевода пациентов».
Подтверждение и проверка программы уборки и дезинфекции больничной палаты
После разработки программы уборки палат персонал больницы должен оценить процедуры, чтобы убедиться, что они работают. Первоначальное валидационное исследование и периодическая проверка программы очистки и санитарии могут предоставить доказательства эффективности процесса. Простой способ определения каждого шага: Валидация включает в себя подтверждение того, что персонал учреждения с самого начала внедрил наиболее эффективные методы очистки. Проверка заключается в том, чтобы убедиться, что сотрудники, выполняющие проверенные методы очистки, делают это правильно.
Проверка заключается в том, чтобы убедиться, что сотрудники, выполняющие проверенные методы очистки, делают это правильно.
Квалифицированная микробиологическая лаборатория может предоставить материалы и услуги по тестированию для этапов Валидации и Верификации. В зависимости от желаемой глубины валидации, некоторые исследования могут включать инокуляцию различных точек испытательного центра суррогатными организмами (похожими, но не такими вирулентными, как MRSA или C. Diff ) с последующей процедурой очистки и санитарной обработки. Мазки берутся и проверяются, чтобы увидеть, как процедура выполняется при известных уровнях загрязнения.
Лаборатория-партнер может иметь суррогатные организмы в своей библиотеке и может выполнить исследование по очистке в рамках Валидации. Многие лаборатории также могут проводить обучение персонала больниц правильным методам асептического взятия проб мазков из окружающей среды.
После завершения валидации команда службы охраны окружающей среды больницы должна запланировать периодический контрольный отбор проб в помещениях для наблюдения за процессом уборки.
CDC рекомендует программу взятия проб мазков в качестве одного из «Объективных методов оценки гигиены окружающей среды» в рамках программы профилактики ИСМП.
Использование тампонов для взятия проб поверхностей в медицинских учреждениях может быть экономичным и действенным способом определить, устраняют ли процессы очистки такие угрозы, как C. diff , MRSA и C. auris , из палат пациентов.
Другие инструменты для отбора проб с поверхности могут включать губки и планшеты для обнаружения и подсчета повторных микроорганизмов (RODAC). Воздухоотстойники и устройства для отбора проб воздуха также полезны для определения общего санитарного состояния помещения.
Проверка чистоты больничных палат
В «Руководстве по инфекционному контролю окружающей среды в медицинских учреждениях» CDC рекомендует собирать информацию и определять параметры перед началом программы отбора проб с поверхности окружающей среды, включая:
- Справочная информация из литературы и текущая деятельность (т.
 е. предварительные результаты эпидемиологического расследования)
е. предварительные результаты эпидемиологического расследования) - Расположение поверхностей, с которых берутся пробы
- Метод отбора проб и соответствующее оборудование для этой задачи
- Необходимое количество повторных образцов, а также контрольные или сравнительные образцы
- Параметры метода анализа пробы и будет ли отбор проб качественным, количественным или и тем, и другим
- Оценка максимально допустимого числа или типов микробов на поверхности(ях), с которых взят образец (см. классификацию Сполдинга для устройств и поверхностей)
- Некоторое ожидание плана корректирующих действий
Чтобы сохранить рентабельность программы профилактики ИСМП, CDC предлагает начать с проверки 10-15% палат для пациентов, и если результаты проверки показывают, что уровень тщательности уборки превышает 80%, сократить выборку до чередующейся периодической группы из 5 % палат. CDC предоставляет список рекомендуемых поверхностей для включения в программу взятия мазков.
Инфекции, связанные с оказанием медицинской помощи: план ликвидации
В 2016 г. Министерство здравоохранения и социальных служб США инициировало Национальный план действий по предотвращению инфекций, связанных с оказанием медицинской помощи: план ликвидации, чтобы «координировать и максимизировать эффективность профилактических мероприятий на уровне федерального правительства». План действий включает в себя сбор данных и разработку профилактических мер в нескольких государственных и частных организациях для снижения угрозы ИСМП в больницах и других медицинских учреждениях. Надзор за медицинскими учреждениями усилился, и от учреждений требуется разработать конкретный план по устранению HAI и документировать планы и результаты очистки и проверки.
Вода как источник внутрибольничных инфекций
Другим источником внутрибольничных инфекций может быть вода. Водные микроорганизмы, такие как Legionella , особенно опасны для больных и немощных людей. Недавно в больнице рядом с Колумбусом, штат Огайо, было обнаружено заражение Legionella в системе горячего водоснабжения, что привело к 16 подтвержденным случаям легионеллеза и одной смерти.
Статья в выпуске Infection Control Today от 14 июня ссылается на исследование, проведенное исследователями из системы здравоохранения Мичиганского университета , которые обнаружили биопленку и присутствие Pseudomonas aeruginosa , плесени и других организмов из окружающей среды в кранах больничных отделений интенсивной терапии. Исследование также отметило, что многие раковины по всему учреждению, используемые персоналом для мытья рук, были слишком мелкими, и в результате вода разбрызгивалась на четыре фута на инструменты и пациентов.
Системы водоснабжения объектов следует периодически проверять на общую микробную нагрузку и Заражение легионеллой . Программа тестирования может включать отбор проб воды из постоянно меняющегося списка питьевых фонтанчиков, раковин, насадок для душа и других мест и отправку их в квалифицированную лабораторию для тестирования.
Вода в нагревательно-охлаждающих устройствах, используемых во время операции на открытой грудной клетке, потенциально может содержать нетуберкулезных микобактерий (НТМ), что приводит к опасным для жизни инфекциям у подвергшихся воздействию пациентов.

 Трафарет, площадью 25 см² накладывают 4 раза в разных местах поверхности контролируемого объекта
Трафарет, площадью 25 см² накладывают 4 раза в разных местах поверхности контролируемого объекта е. предварительные результаты эпидемиологического расследования)
е. предварительные результаты эпидемиологического расследования)