Вирусы и механизмы возникновения их мутаций
01.03.2021
Скачать статью о мутациях вирусов докт. мед. наук, профессора Писаренко Л.В.
Размер: 992 Кб
Вирусология занимает важное место среди биологических дисциплин. Современный медицинский или ветеринарный специалист должен знать не только клинико–патологическую сторону заболевания, но и иметь четкое представление о вирусах, их свойствах, методах лабораторной диагностики и свойствах постинфекционного и поствакцинального иммунитета.
Вирус (от лат. virus — яд) является простейшей неклеточной формой жизни в виде микроскопической биологической частицы, представляющей собой молекулы нуклеиновых кислот (ДНК или РНК), заключённых в защитную белковую оболочку (капсид) и способные инфицировать живые организма.
Вирусы являются облигатными внутриклеточными паразитами человека, животных, растений, насекомых, бактерий, грибов, простейших и других живых существ и изменяют свои свойства как в естественных условиях размножения, так и в экспериментах.
- мутации, то есть изменении последовательности нуклеотидов в определенной области генома вируса, что приводит к фенотипически выраженному изменению свойства;
- рекомбинации, то есть обменом генетическим материалом между двумя вирусами, близкими, но различными по наследственным свойствам.
Значительная часть известных человеку вирусов имеют свои особые морфофункциональные и патогенные свойства, чем и вызывают вирусные заболевания у животных и людей. Среди таковых выделяют ДНК- и РНК-содержащие вирусы.
Мутации у вирусов
Мутация — это изменчивость, связанная с изменениями в самих генах. Она может быть прерывистой, скачкообразной и приводить к стойким изменениям наследственных свойств вирусов. Все вирусные мутации делятся на две группы:
- спонтанные;
- индуцированные (вызванные).

По своей протяжённости они делятся на точечные и аберрационные (изменения, затрагивающие значительную часть генома).
Точечные мутации вызываются замещением одного нуклеотида (для РНКсодержащих вирусов). Такие мутации иногда можно обратить вспять с восстановлением первоначальной структуры генома. Однако мутационные изменения могут захватывать большие части молекул нуклеиновых кислот, то есть несколько нуклеотидов. Также в этом случае может происходить выпадения, вставки и перемещения (транслокация) целых участков и даже повороты участков на 180° (так называемая инверсия), смещения каркаса считывания – более крупные перестройки в структуре нуклеиновых кислот, а следовательно, нарушение генетической информации.
Но точечные мутации не всегда приводят к изменению фенотипа. Существует целый ряд причин, по которым такие мутации не могут проявляться. Одна из них — вырождение генетического кода. Код синтеза белка вырождается, что означает, что некоторые аминокислоты могут быть закодированы несколькими триплетами (кодонами).
Поэтому ни структура белка, ни его биологические свойства не нарушаются. Природа использует своего рода синонимичный язык и, заменяя один кодон другим, закладывает в них одно и то же понятие (аминокислоту), тем самым сохраняя естественную структуру и функцию синтезируемого белка.
Другое дело, если аминокислота кодируется только одним триплетом, например, синтез триптофана кодируется и заменяется только триплетом УГГ, то есть синонимом, который отсутствует. В этом случае в белок включается еще одна какаялибо аминокислота, которая может привести к появлению мутантного признака.
Аберрация в фагах вызвана делециями (потерями) различного числа нуклеотидов, от одной пары до последовательности, вызывающей одну или несколько функций вируса. Как спонтанные, так и индуцированные мутации также делятся на прямые и обратные мутации.
Например, увеличивается или уменьшается размер бляшек под агарным покрытием; увеличивается или ослабевает вирулентность для определенного вида животных; вирус становится более чувствительным к действию химиотерапевтического агента и т. д.
В других случаях мутация является фатальной, поскольку она нарушает синтез или функцию жизненно важного вирусного белка, например, такого как вирусная полимераза. В некоторых случаях мутации являются условно летальными, так как вирусспецифический белок сохраняет свои функции при определенных условиях и теряет эту способность в неразрешающих (непермиссивных) условиях.
Типичным примером таких мутаций являются термочувствительные – ТS-мутации, при которых вирус теряет способность к размножению при повышенных температурах (+39-42°С), сохраняя эту способность при нормальных температурах роста (+36-37°С). Морфологические или структурные мутации могут влиять на размер вириона, первичную структуру вирусных белков и изменения в генах, определяющих ранние и поздние вирусные ферменты, обеспечивающие размножение вируса. Мутации также могут быть различными по своему механизму.
Морфологические или структурные мутации могут влиять на размер вириона, первичную структуру вирусных белков и изменения в генах, определяющих ранние и поздние вирусные ферменты, обеспечивающие размножение вируса. Мутации также могут быть различными по своему механизму.
В одних случаях происходит делеция, то есть потеря одного или нескольких нуклеотидов, в других — встраивание одного или нескольких нуклеотидов, а в некоторых случаях один нуклеотид заменяется другим. Мутации могут быть прямыми или обратными. Прямые мутации меняют фенотип, а обратные мутации – реверсии) — восстанавливаются. Реальная реверсия возможна, когда обратная мутация происходит вместе с первичным повреждением, и псевдореверсия, когда мутация происходит в другой области дефектного гена (интрагенное торможение мутации) или в другом гене (экстрагенное подавление мутации).
Реверсия — не редкое явление, потому что ревертанты обычно лучше приспособлены к данной клеточной системе. Поэтому при создании мутантов с определенными свой ствами, например, вакцинных штаммов, следует ожидать возможного превращения их в дикий тип.
Изменения могут влиять на размер, форму, патогенность, антигенную структуру, тканевую тропность, устойчивость к физико-химическим воздействиям и на другие свойства вирусов. Значение причин, механизмов и характера изменений имеет большое значение при получении необходимых вакцин для вирусных штаммов, а также для разработки эффективных мер борьбы с вирусными эпизодами, в ходе которых, как известно, свойства вирусов могут существенно изменяться.
Мутация вирусов может происходить в результате химических изменений цистронов или нарушения последовательности их расположения в структуре молекулы вирусной нуклеиновой кислоты. В зависимости от условий различают естественную изменчивость вирусов, наблюдаемую в нормальных условиях размножения, и искусственную изменчивость, получаемую в результате многочисленных специальных пассажей или воздействия на вирусы определенных физических или химических факторов (мутагенов).
Этот признак наиболее заметен у вируса гриппа и вирус ящера. Значительная изменчивость отмечается у вируса гриппа. Об этом свидетельствует большое количество вариантов у разных типов этих вирусов, а также значительные изменения его антигенных свойств в конце почти каждой эпизоотии.
Частота мутаций и механизмы их возникновения
Мутации бактериофагов изучались очень интенсивно не только с целью генетического анализа, но и с целью получения информации о свойствах самих фагов. Частота появления мутантов в потомстве фагов варьируется очень сильно: например, одни мутанты образуются с частотой не более 10, а другие-с частотой 10 и выше. Неблагоприятное воздействие высокочастотных мутаций обычно компенсируется эффектом отбора. Например, мутантный фаг может быть заменен диким типом, что дает более высокий выход фага. Высокая частота вспышек обычно характерна для таких мутаций, которые могут происходить как во многих локусах, так в одном и том же локусе.
В тех случаях, когда нормальный признак соответствует функциональной форме гена, а мутант появляется в результате изменения в любой точке локуса, частота прямых мутаций окажется выше, чем частота обратных мутаций, так как обратные мутации должны приводить к восстановлению нормального состояния. Иногда ревертанты на самом деле являются псевдоревертантами: это происходит либо из-за изменений в другом гене (мутации-супрессоры), либо из-за изменений в том же гене, которые вызывают другую, но также активную форму продукта.
У зрелых фагов частота спонтанных мутаций очень мала, но они могут быть индуцированы под влиянием таких мутагенных факторов, как рентгеновские или ультрафиолетовые лучи, азотистая кислота, гидроксиламин или алкилирующие агенты. Азотистая кислота дезаминирует основания нуклеотидов, а этилметилсульфат их этилирует. Гидроксиламин превращает шитозин в урацил. В результате ошибок, допущенных при репликации химически модифицированной нуклеиновой кислоты, происходят мутации, и потомство фагов, полученное из бактерии, содержит как нормальные, так и мутантные частицы. Однако, как и при обработке мутагенного фага, содержащего одноцепочную ДНК, образуется чистый мутантный клон.
Однако, как и при обработке мутагенного фага, содержащего одноцепочную ДНК, образуется чистый мутантный клон.
Изучение мутационного процесса, происходящего при размножении фагов, непосредственно связано с анализом развития фагов. Давайте рассмотрим процесс спонтанной мутации. В бактериальной клетке, в которой произошла мутация фага, 6 образуются как нормальный, так и мутировавший фаги. Количество мутантных фаговых частиц, содержащихся в популяции фагов, происходящих из этой отдельной бактериальной клетки, очевидно, определяется характером размножения фагов, поскольку новые гены могут быть сформированы только путем репликации уже существующих. Если вероятность мутации одинакова для каждой репликации, то число мутантов зависит от механизма репликации.
Например, если каждая новая копия гена формируется независимо от других, то распределение мутантных копий в потомках фагов от разных инфицированных бактерий будет случайным. Если же, наоборот, каждая из полученных копий воспроизводится, то в свою очередь мутантные копии будут разделены на группы или клоны, состоящие из мутантных «сибсов».
Индуцированные хозяином модификации бактериофагов
Помимо мутаций, бактериофаги подвержены негенетическим изменениям, в которых главная роль принадлежит клетке-хозяину. Это явление было названо модификациями, вызванными хозяином. Значение этих модификаций для молекулярной биологии состоит в том, что они показали способность внутриклеточной среды вызывать такие изменения в химической структуре генетического материала, которые могут быть использованы для идентификации клеточных линий, синтезирующих ДНК.
Подобные явления были впервые обнаружены на фаговой ДНК, но они также справедливы и для каждой бактериальной клеточной ДНК. Есть также наблюдения, при которых это явление относится и к эукариотическим клеткам. В особых случаях могут возникнуть более сложные ситуации. Двустороннее ограничение фага двумя хозяевами иногда наблюдается, но оно не обязательно. Фаги, отторгнутые клетками, способны адсорбироваться на них и проникать в их ДНК добавляя часть собственной ДНК. Однако последняя часть быстро разрушается, и репликация не происходит.
Однако последняя часть быстро разрушается, и репликация не происходит.
Деградация ДНК вызывается специфическими эндонуклеазами (рестриктазами или R-нуклеазами), которые могут обнаруживать и расщеплять определенные участки ДНК, если они не были модифицированы под влиянием М-ферментов. После этого ДНК расщепляется экзонуклеазами на отдельные нуклеотиды. Бактериальный штамм может иметь одну или несколько R-нуклеаз и в то же время M-ферменты, которые защищают собственную ДНК клетки. Предложена удобная номенклатура этих ферментов. Согласно ряду данных, области детекции R-нуклеазы не всегда совпадают с областями расщепления ДНК; возможно, что фермент может мигрировать по цепочке до того, как найдет область, где происходит расщепление ДНК. Функциональная роль индуцированных хозяином модификаций неясна.
Они способны защитить этот штамм бактерий от массового уничтожения фагами, растущими на различных бактериях. В более общем плане роль модификаций можно определить как защиту от проникновения неприемлемой чужеродной ДНК в бактериальную клетку и ее последующего «приживления». Бактерия А, которая отвергает фаги, размноженные на штамме В, также отвергает ДНК бактерии В, когда она вводится путем конъюгации или трансдукции.
Бактерия А, которая отвергает фаги, размноженные на штамме В, также отвергает ДНК бактерии В, когда она вводится путем конъюгации или трансдукции.
Как видим, мутирование вирусов проходит достаточно сложный и тернистый путь в приобретении новых вирулентных свойств. Эти свойства могут быть как ослабляющими для развития инфекционного процесса, так и крайне агрессивными в своём новом виде.
Возврат к списку
Поделиться:
Конспиративная пандемия
ВОЗ узнала об этой эпидемии только через 9 месяцев после ее начала. Припозднившийся с докладом Китай поспешил заверить партнеров, что китайские ученые не только не работали с вирусом-возбудителем — в лабораториях не было даже его образцов. Тем не менее, 40 лет спустя во вспышке «русского гриппа» принято винить именно ученых и медиков.
После пандемии «испанки» 1918 года вирус гриппа никуда не исчез. Мы мало знаем о том, как и какими гриппами люди болели до этого, но после пандемии штамм h2N1 надолго стал главным гриппом на планете — им заражались каждую зиму. Именно поэтому в 1957-м h2N1 проиграл «азиатскому гриппу» из Китая, h3N2: за сорок лет иммунитет к нему, если раньше и был, то пропал, и новичок из Китая, спровоцировав новую пандемию, полностью выбил своего предшественника из популяции.
Именно поэтому в 1957-м h2N1 проиграл «азиатскому гриппу» из Китая, h3N2: за сорок лет иммунитет к нему, если раньше и был, то пропал, и новичок из Китая, спровоцировав новую пандемию, полностью выбил своего предшественника из популяции.
Новый тиран продержался на своем троне всего 11 лет. В 1968 году на смену ему пришел штамм h4N2, который получил имя «гонконгского гриппа» (хотя некоторые ученые подозревали, что родиной и этого штамма был Китай). Он тоже быстро вытеснил своего предшественника, хотя оказался менее смертельным — возможно, потому что сохранил нейраминидазу N2, антитела к которой у людей появились за годы «царствия» h3N2.
Литеры H и N в именах штаммов гриппа обозначают две молекулы, которые позволяют им прикрепляться к рецепторам на человеческих клетках. Гемагглютинин, H, прилипает к углеводным «хвостам», которые висят на рецепторах клеток хозяина. Нейраминидаза, N, отрезает эти хвосты, если гемагглютинин промахнулся, и дает ему шанс попробовать снова — пока не найдет нужный.
Всего известно несколько десятков вариантов генов для H и N, однако большинство из них встречается только у вирусов птичьего гриппа. Тем не менее, иногда какой-нибудь штамм «перепрыгивает» к человеку.
Чаще всего это происходит после реассортации: птичий грипп встречается с человеческим в теле какого-нибудь животного, которое способно подхватить оба вируса (этим животным обычно оказывается свинья), и один грипп делится с другим частью своих генов. В результате получается гибрид, который несет новые варианты H и N, полученные от птичьего гриппа, и гены, помогающие заражать людей — от человеческого. Судя по всему, именно так появились на свет штаммы «азиатского» (h3N2) и «гонконгского» (h4N2) гриппов.
Но и после того, как вирус попал к людям, его эволюция не останавливается. Он может накапливать точечные замены и другие мутации в разных своих генах, не только H и N, и по этим мутациям можно восстановить его родословную. Кроме того, вирус может «перепрыгнуть» дальше — например, к свинье — и встретиться там с другим вариантом гриппа.
Еще через восемь лет, в 1976-м, h2N1 вернулся — им заболели две с лишним сотни человек на военной базе в США. Перепугавшись, власти вакцинировали четверть всего населения страны — и пандемии не случилось. Тогда американский микробиолог Эдвин Килберн решил, не дожидаясь следующего «переворота», разобраться, по какой закономерности возникают эпидемии гриппа.
В то время была популярна гипотеза «антигенного ресайклинга», согласно которой у гриппа есть ограниченный набор штаммов, и они просто «всплывают» в популяции с определенной периодичностью. Первый раз h2N1 пришел к людям в 1918-м, второй раз — в 1976. Между этими событиями прошло 58 лет. h3N2 и h4N2 появились в 1957-м и 1968-м — но, вероятно, не в первый раз. Антитела из крови долгожителей свидетельствуют о том, что похожими штаммами люди уже болели — примерно в 1889 и 1900 годах. То есть интервал составил 68 лет. А если так, рассудил Килберн, то штаммы должны возвращаться через 60-70 лет после своей последней вспышки. Поэтому, раз самая свежая вспышка — которую вовремя остановили — уже случилась в 1976, следующую встречу с h2N1 можно было ждать ближе к середине XXI века.
Но Килберн ошибся. Он вернулся уже через год.
Русский грипп
5 ноября 1977 года выяснилось, что 22-летний москвич с симптомами гриппа носит в себе не «царствующий» штамм h4N2, а «свергнутый» 20 лет назад h2N1. Через несколько дней о таких же пациентах отчитались врачи в Находке, а потом и в Хабаровске. 7 декабря советские врачи оповестили о своих наблюдениях ВОЗ. 8 декабря h2N1 нашли в Гонконге. Список стран расширялся быстро: через полтора месяца их было уже более десятка, и в течение зимы 1977-78 года h2N1 встречали по всему миру, от Ирана до Чили.
Однако c момента низвержения h2N1 прошло всего 20 лет, и большая часть людей на Земле им уже переболела и его запомнила. Поэтому в этой пандемии пострадали в основном дети и молодежь — те, для чьих иммунных систем он был по-настоящему в новинку. Но и для них вирус оказался не таким смертельным, как его предшественники: от него гибли примерно пятеро из 100 тысяч зараженных (это даже меньше, чем для сезонного гриппа). Всего на счету у пандемии «русского гриппа» около 700 тысяч смертей — что, конечно, примерно в два раза больше, чем убивают ежегодные эпидемии гриппа в наши дни — но в два раза меньше, чем погибших в пандемию «гонконгского гриппа» 1968 года, в пять раз меньше, чем у «азиатского» 11 годами ранее, и в несколько десятков раз меньше, чем погибло в от h2N1 в годы Первой мировой.
Всего на счету у пандемии «русского гриппа» около 700 тысяч смертей — что, конечно, примерно в два раза больше, чем убивают ежегодные эпидемии гриппа в наши дни — но в два раза меньше, чем погибших в пандемию «гонконгского гриппа» 1968 года, в пять раз меньше, чем у «азиатского» 11 годами ранее, и в несколько десятков раз меньше, чем погибло в от h2N1 в годы Первой мировой.
| Пандемия | Вирус | Число жертв |
|---|---|---|
| «Испанский грипп» 1918-1919 |
h2N1 | 50 миллионов человек |
| «Азиатский грипп» 1957-1963 |
h3N2 | 2-4 миллиона человек |
| «Гонконгский грипп» 1968–1970 |
h4N2 | 1-2 миллиона человек |
| «Русский грипп» 1977–1979 |
h2N1 | 0,7 миллиона человек |
К началу 1978 года СССР со своей вспышкой справился и передал эстафету другим странам. А когда вирус дошел до США, американские ученые взялись выяснять, почему предсказания Килборна не сбылись. Они стали проверять, как на «русский грипп» реагируют антитела к гриппам прежних лет — и заметили, что сильнее всего он похож не на последний вариант в «династии» h2N1 (1956 года), а на его предшественника из 1950-го. Причем разница между нуклеотидной последовательностью «русского гриппа» и штаммом 50-го была в несколько раз меньше, чем разница между штаммом 56-го и 50-го. Получается, что вирус 1950-го года не просто где-то пересидел 27 лет (например, циркулируя в какой-то изолированной популяции), а в буквальном смысле слова «проспал» эти годы — то есть не накопил тех изменений, которые положены любому вирусу, размножающемся в популяции своих хозяев.
А когда вирус дошел до США, американские ученые взялись выяснять, почему предсказания Килборна не сбылись. Они стали проверять, как на «русский грипп» реагируют антитела к гриппам прежних лет — и заметили, что сильнее всего он похож не на последний вариант в «династии» h2N1 (1956 года), а на его предшественника из 1950-го. Причем разница между нуклеотидной последовательностью «русского гриппа» и штаммом 50-го была в несколько раз меньше, чем разница между штаммом 56-го и 50-го. Получается, что вирус 1950-го года не просто где-то пересидел 27 лет (например, циркулируя в какой-то изолированной популяции), а в буквальном смысле слова «проспал» эти годы — то есть не накопил тех изменений, которые положены любому вирусу, размножающемся в популяции своих хозяев.
Как это могло произойти, было совершенно непонятно. Если вирус вернулся — значит, должен быть какой-то резервуар, где он хранился. Но это не могли быть ни люди, ни животные — иначе вирус бы постоянно размножался и мутировал. Некоторые исследователи штамма 1977 года предположили, что геном h2N1 сохранился неизменным посредством некого «уникального механизма» — и высказали целый ворох осторожных идей по поводу того, каким он мог быть. Например, допустили, что вирус мог накопить ряд изменений, а потом «откатить» их обратно. Или мог в буквальном смысле замерзнуть где-то в природе (позже вирус гриппа действительно обнаружили вмерзшим в лед одного сибирского озера), затем оттаять и начать снова заражать людей. Или мог проспать 27 лет в организме какого-нибудь хронически больного человека или животного.
Например, допустили, что вирус мог накопить ряд изменений, а потом «откатить» их обратно. Или мог в буквальном смысле замерзнуть где-то в природе (позже вирус гриппа действительно обнаружили вмерзшим в лед одного сибирского озера), затем оттаять и начать снова заражать людей. Или мог проспать 27 лет в организме какого-нибудь хронически больного человека или животного.
Их коллеги, впрочем, сразу усомнились в правдоподобности этих версий и назвали эпидемию рукотворной.
Чей это грипп
Но никто не обратил на это большого внимания и не бросился искать «секретную советскую лабораторию», из которой мог бы сбежать h2N1. Дело в том, что в начале 1978 года ВОЗ получила
сообщение из Китая: первые случаи заболевания новым штаммом там зафиксировали сразу в нескольких провинциях еще в мае 1977-го, а к октябрю эпидемия охватила всю страну. Значит, «русский грипп» мог быть вовсе не русским — ведь в Москве он появился в ноябре того же года. Но переименовывать его никто уже не стал.
Тем не менее, китайские власти, доложив о своих вспышках, одновременно открестились от подозрений — они подчеркнули, что лаборатории, которые идентифицировали «русский грипп», сами по себе гриппом не только не занимались, но даже не хранили его образцов.
Проверять, так ли это на самом деле, никто не взялся. В течение года пандемия «русского гриппа» захлебнулась, и мир вернулся к привычному графику сезонных эпидемий. ВОЗ даже не признала случившееся пандемией официально, как не признает ежегодные вспышки гриппа — поскольку, во-первых, новый штамм оказался «давно забытым старым», а во-вторых, не вытеснил из популяции доминировавший тогда h4N2. В мире хватало других непобежденных инфекций (и оставалось несколько лет до вспышки ВИЧ), и у вирусологов нашлись дела поважнее, чем рассуждать, где проспал и почему проснулся очередной вариант гриппа, заразный только для молодежи и менее смертельный, чем обычно.
Чуть более активны в этом отношении были советские ученые: пытались отвести от своей страны подозрения, объясняя, что штамм 1977 года — это не какой-то «замороженный» вариант, а результат реассортации нескольких вирусных вариантов. Но с ними даже никто не спорил. На несколько десятилетий вирус остался безродным, а редкие обзоры, на страницах которых он встречался, упоминали лишь, что он провел 27 лет «вероятно, замороженным», а его пробуждение — «таинственно».
Но с ними даже никто не спорил. На несколько десятилетий вирус остался безродным, а редкие обзоры, на страницах которых он встречался, упоминали лишь, что он провел 27 лет «вероятно, замороженным», а его пробуждение — «таинственно».
Почти 30 лет спустя, в 2006-м, Эдвин Килборн снова написал статью, в которой попытался извлечь уроки из предыдущих вспышек. Признавая свои прежние неудачи, он назвал пандемии гриппа «мутным стеклянным шаром», в котором не видно будущего. А событие 1977 года отнес к «псевдопандемиям» — мол, слишком малой кровью она обошлась человечеству. И вскользь напомнил: ее виновник все еще неизвестен и это может быть следствие экспериментов с вирусами. А если так, то это первый случай, когда лабораторные эксперименты спровоцировали эпидемию. Однако разбираться в ней Килборн не планировал. Напротив, он предложил все усилия бросить на слежку за новичком — H5N1, который недавно начал «прыгать» на людей от птиц.
И снова не угадал.
Лабораторный аргумент
В 2009 году пандемия гриппа вернулась — ее виновником снова стал вариант h2N1, перепрыгнувший от свиней (за что и получил имя «свиного гриппа»). Впрочем, в версию со свиньями верили не все — особенно учитывая, что первый известный пациент (мы писали о нем в тексте «Дары любви») был мексиканским мальчиком и никогда со свиньями не встречался.
Впрочем, в версию со свиньями верили не все — особенно учитывая, что первый известный пациент (мы писали о нем в тексте «Дары любви») был мексиканским мальчиком и никогда со свиньями не встречался.
Австралийский вирусолог на пенсии Эдриан Гиббс заметил в геноме вируса признаки ускоренной эволюции — и поделился этими соображениями со своими старыми знакомыми из ВОЗ. Об этом узнали журналисты, поэтому организации пришлось разослать рукопись Гиббса группам экспертов, а тем — сформулировать свои опровержения «лабораторной» версии. Тем временем вирусологи стали перебирать предыдущие вспышки и размышлять, встречались ли они когда-то еще с лабораторной утечкой — или чем-то на нее похожим.
Таких примеров, на самом деле, было много. Из лабораторий в разные годы сбегали и оспа, и коронавирусы, и даже сибирская язва — но каждый раз утечку быстро замечали, пресекали, и вспышка ограничивалась несколькими жертвами (а ликвидаторы зачастую воздерживались от комментариев).
Чуть более удачным примером служит вспышка гриппа в Монголии в 1988 году. Тогда люди заболели штаммом, ряд генов которого в последний раз встречали в Пуэрто-Рико аж в 1934 году. Но на этот раз было ясно, где они пролежали 54 года. Гены старого гриппа попали в Монголию вместе с вакциной, которую разработали в 1978 году в Ленинграде, совместив штаммы 1977 и 1934 года. Судя по всему, препарат оказался не полностью инактивированным — и часть вакцинных вирусов начала распространяться среди населения. Но лабораторной утечкой в чистом виде эту историю назвать было нельзя.
Тогда люди заболели штаммом, ряд генов которого в последний раз встречали в Пуэрто-Рико аж в 1934 году. Но на этот раз было ясно, где они пролежали 54 года. Гены старого гриппа попали в Монголию вместе с вакциной, которую разработали в 1978 году в Ленинграде, совместив штаммы 1977 и 1934 года. Судя по всему, препарат оказался не полностью инактивированным — и часть вакцинных вирусов начала распространяться среди населения. Но лабораторной утечкой в чистом виде эту историю назвать было нельзя.
Оставался загадочный грипп 1977 года. На фоне монгольской истории стало понятно, что его происхождение тоже может быть связано с вакциной. Аргументов в пользу этого можно найти по меньшей мере три.
Во-первых, он «проснулся» через год после вспышки h2N1, той самой, которая не вышла за пределы военной базы в США. Это могло подстегнуть производство и испытания вакцин не только в США, но и в других странах. По крайней мере, известно, что вакцину от h2N1 массово производили в Одессе в 1977-м.
Во-вторых, вирус 1977 года довольно мягко обращался со своими жертвами — а значит, его могли намеренно «смягчить» или случайно «недобить» в лабораторных условиях.
В-третьих, еще в 1977-м заметили, что вирус «русского гриппа» чувствителен к температуре — и при 38 градусах гораздо хуже размножается в клетках, чем при 34. Это тоже типичный признак вируса, ослабленного лабораторными манипуляциями.
Эти аргументы выглядели убедительными, и ученые один за другим в своих обзорах переходили от «таинственного» происхождения вируса к «вакцинному». В 2015 году два ученых из Балтимора построили график упоминаний гриппа-1977 в литературе и встречаемости версий о его происхождении. На графике видно затишье в первые годы после самой эпидемии, затем «волна» упоминаний после пандемии 2009 года. А потом еще одна, в 2014 году — на фоне дебатов о том, стоит ли разрешать лабораторные эксперименты с потенциальными возбудителями пандемий.
Тем не менее, напомнили балтиморцы, конкретную траекторию побега h2N1 восстановить так и не удалось. Версий произошедшего тоже три:
Версий произошедшего тоже три:
- Грипп 1977 года мог сбежать из лаборатории, где его «разводили на вакцину».
- Он мог остаться «недобитым» и из вакцины перейти в разряд патогенов — как это произошло в Монголии.
- Его могли ослабить и затем использовать для направленного заражения людей (так называемых human challenge study), чтобы проверить, работает ли настоящая вакцина (о такого рода экспериментах мы рассказывали в материале «Болей за нас»). То есть вакцина не сработала, испытуемые заболели — и передали «тестовый» вирус в популяцию.
Однозначных доказательств в пользу какого-либо из этих сценариев до сих пор никто не нашел. Единственное свидетельство, которым сегодня мы располагаем — слова доктора Чу, китайского вирусолога и бывшего директора Китайской академии медицинских наук. Считается, что он подтвердил: эпидемия 1977 года — следствие китайских испытаний вакцины, в ходе которых военных заражали экспериментальным штаммом h2N1. Однако мы знаем об этом только из статьи американского вирусолога Питера Палезе, который пересказывает личную переписку с доктором Чу. Никаких официальных подтверждений этим словам нет. Поэтому, заключили балтиморцы, странно использовать грипп 1977 года как пример опасностей, которыми грозят эксперименты с вирусами.
Никаких официальных подтверждений этим словам нет. Поэтому, заключили балтиморцы, странно использовать грипп 1977 года как пример опасностей, которыми грозят эксперименты с вирусами.
Но научное сообщество с ними не согласилось. Более того, им возражали: неважно, мол, в какой момент произошла утечка и насколько рукотворна эта вспышка. Важно только то, что грипп 1977 года попал к людям из лаборатории, а не от животных. А значит, сам факт наличия потенциально опасных вирусов в руках ученых представляет собой угрозу.
Так вирус 1977 года утвердился в качестве единственного примера лабораторной утечки, которая спровоцировала пандемию. Вслед за пиком упоминаний в 2009 и 2014 годах у нас на глазах растет еще один — по мере того как набирает обороты дискуссия о лабораторном или природном происхождении SARS-CoV-2 (подробнее эту версию мы разбирали больше года назад, в материале «Сам ты искусственный»).
Тем временем, никаких новых данных об истории непризнанной пандемии 1977 года у нас так и не появилось. Единственное, что мы сейчас знаем наверняка о «русском гриппе» — это то, что он был. Потому что только с 1978 года в царстве гриппа — «двоевластие»: h2N1 и h4N2 каждую зиму возвращаются к нам вместе.
Единственное, что мы сейчас знаем наверняка о «русском гриппе» — это то, что он был. Потому что только с 1978 года в царстве гриппа — «двоевластие»: h2N1 и h4N2 каждую зиму возвращаются к нам вместе.
Полина Лосева
БИОЛОГИЯ ВИРУСОВ ГРИППА
1. Palese P, Shaw ML. Ортомиксовирусы: вирусы и их репликация. В: Knipe DM, Howley PM, редакторы. Вирусология Филдса. Филадельфия: Липпинкотт Уильямс и Уилкинс; 2007. [Google Scholar]
2. Zebedee SL, Lamb RA. Белок М2 вируса гриппа А: ограничение роста вируса моноклональными антителами и обнаружение М2 в вирионах. Дж Вирол. 1988 г., август; 62 (8): 2762–72. [Бесплатная статья PMC] [PubMed] [Google Scholar]
3. Chen W, Calvo PA, Malide D, Gibbs J, Schubert U, Bacik I, et al. Новый митохондриальный белок вируса гриппа А, вызывающий гибель клеток. Нат Мед. 2001 г., декабрь; 7 (12): 1306–12. [PubMed] [Академия Google]
4. Hatta M, Kawaoka Y. Белок NB вируса гриппа B не является необходимым для репликации вируса in vitro. Дж Вирол. 2003 г., май; 77 (10): 6050–4. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Дж Вирол. 2003 г., май; 77 (10): 6050–4. [Бесплатная статья PMC] [PubMed] [Google Scholar]
5. Lamb RA, Lai CJ, Choppin PW. Последовательности мРНК, полученные из сегмента геномной РНК 7 вируса гриппа: коллинеарные и прерванные мРНК кодируют перекрывающиеся белки. Proc Natl Acad Sci U S A. 1981 Jul; 78 (7): 4170–4. [Бесплатная статья PMC] [PubMed] [Google Scholar]
6. Briedis DJ, Lamb RA, Choppin PW. Последовательность сегмента 7 РНК генома вируса гриппа B: частичная гомология аминокислот между мембранными белками (M1) вирусов гриппа A и B и сохранение второй открытой рамки считывания. Вирусология. 1982 30 января; 116 (2): 581–588. [PubMed] [Google Scholar]
7. Horvath CM, Williams MA, Lamb RA. Эукариотическая сопряженная трансляция тандемных цистронов: идентификация полипептида BM2 вируса гриппа B. EMBO J. 1990 авг.; 9 (8): 2639–47. [Статья бесплатно PMC] [PubMed] [Google Scholar]
8. Dauber B, Heins G, Wolff T. Неструктурный белок NS1 вируса гриппа B необходим для эффективного роста вируса и противодействует индукции бета-интерферона. Дж Вирол. 2004 г., февраль; 78 (4): 1865–72. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Дж Вирол. 2004 г., февраль; 78 (4): 1865–72. [Бесплатная статья PMC] [PubMed] [Google Scholar]
9. Гарсия-Састре А. Ингибирование интерферон-опосредованного противовирусного ответа вирусами гриппа А и другими РНК-вирусами с отрицательной цепью. Вирусология. 2001 г., 20 января; 279 (2): 375–84. [PubMed] [Google Scholar]
10. Кохс Г., Гарсия-Састре А., Мартинес-Собридо Л. Множественные антиинтерфероновые действия белка NS1 вируса гриппа А. Дж Вирол. 2007 г., июль; 81 (13): 7011–21. [Бесплатная статья PMC] [PubMed] [Google Scholar]
11. Briedis DJ, Lamb RA. Геном вируса гриппа B: последовательности и структурная организация сегмента 8 РНК и мРНК, кодирующих белки NS1 и NS2. Дж Вирол. 1982 апреля; 42 (1): 186–93. [Бесплатная статья PMC] [PubMed] [Google Scholar]
12. Lamb RA, Choppin PW, Chanock RM, Lai CJ. Картирование двух перекрывающихся генов полипептидов NS1 и NS2 на 8-м сегменте РНК генома вируса гриппа. Proc Natl Acad Sci U S A. 1980 Apr; 77 (4): 1857–61. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
13. Baudin F, Bach C, Cusack S, Ruigrok RW. Структура РНП вируса гриппа. I. Нуклеопротеин вируса гриппа плавит вторичную структуру в РНК-ручке и подвергает основания действию растворителя. EMBO J. 1994 1 июля; 13 (13): 3158–65. [Бесплатная статья PMC] [PubMed] [Google Scholar]
14. Compans RW, Content J, Duesberg PH. Структура рибонуклеопротеина вируса гриппа. Дж Вирол. 1972 г., октябрь; 10 (4): 795–800. [Бесплатная статья PMC] [PubMed] [Google Scholar]
15. Мурти К.Г., Вебстер Р.Г., Джонс И.М. Локализация РНК-полимераз на рибонуклеопротеинах вируса гриппа с помощью мечения иммунозолотом. Вирусология. 1988 г., июнь; 164 (2): 562–6. [PubMed] [Google Scholar]
16. Pappas C, Aguilar PV, Basler CF, Solorzano A, Zeng H, Perrone LA, et al. Одногенные реассортанты определяют критическую роль PB1, HA и NA в высокой вирулентности 1918 пандемический вирус гриппа. Proc Natl Acad Sci U S A. 2008 Feb 26;105(8):3064–9.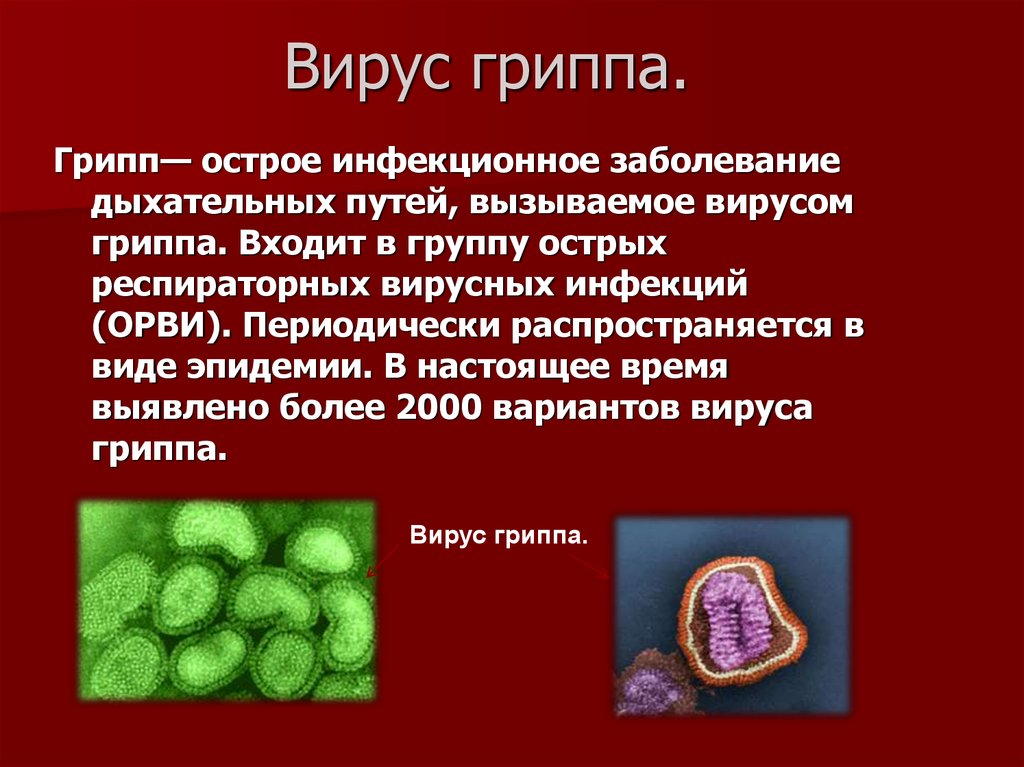 [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
17. Tumpey TM, Basler CF, Aguilar PV, Zeng H, Solorzano A, Swayne DE, et al. Характеристика реконструированного вируса пандемии испанского гриппа 1918 года. Наука. 2005 г., 7 октября; 310 (5745): 77–80. [PubMed] [Google Scholar]
18. Ахмед Р., Олдстоун М.Б., Палезе П. Защитный иммунитет и восприимчивость к инфекционным заболеваниям: уроки пандемии гриппа 1918 года. Нат Иммунол. 2007 ноябрь; 8 (11): 1188–93. [Бесплатная статья PMC] [PubMed] [Google Scholar]
19. Couceiro JN, Paulson JC, Baum LG. Штаммы вируса гриппа избирательно распознают сиалилоолигосахариды на респираторном эпителии человека; роль клетки-хозяина в выборе специфичности рецептора гемагглютинина. Вирус Рез. 1993 г., август; 29 (2): 155–65. [PubMed] [Google Scholar]
20. Матросович М.Н., Матросович Т.Ю., Грей Т., Робертс Н.А., Кленк Х.Д. Вирусы гриппа человека и птиц нацелены на разные типы клеток в культурах эпителия дыхательных путей человека. Proc Natl Acad Sci U S A. 30 марта 2004 г .; 101 (13): 4620–4. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Proc Natl Acad Sci U S A. 30 марта 2004 г .; 101 (13): 4620–4. [Бесплатная статья PMC] [PubMed] [Google Scholar]
21. Беар А.С., Вебстер Р.Г. Репликация вирусов птичьего гриппа в организме человека. Арх Вирол. 1991;119(1–2):37–42. [PubMed] [Google Scholar]
22. Murphy BR, Hinshaw VS, Sly DL, London WT, Hosier NT, Wood FT, et al. Вирулентность вирусов птичьего гриппа А для беличьих обезьян. Заразить иммун. 1982 г., сен; 37 (3): 1119–26. [Бесплатная статья PMC] [PubMed] [Google Scholar]
23. Tian SF, Buckler-White AJ, London WT, Reck LJ, Chanock RM, Murphy BR. Гены нуклеопротеинов и мембранных белков связаны с ограничением репликации вируса гриппа A/Mallard/NY/78 и его реассортантов в дыхательных путях беличьих обезьян. Дж Вирол. 1985 марта; 53 (3): 771–75. [Бесплатная статья PMC] [PubMed] [Google Scholar]
24. Gambotto A, Barratt-Boyes SM, de Jong MD, Neumann G, Kawaoka Y. Заражение человека высокопатогенным вирусом гриппа H5N1. Ланцет. 2008 г., 26 апреля; 371 (9622): 1464–75. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
25. Wilson IA, Skeheel JJ, Wiley DC. Структура гликопротеина мембраны гемагглютинина вируса гриппа при разрешении 3 А. Природа. 1981 г., 29 января; 289 (5796): 366–73. [PubMed] [Google Scholar]
26. Webster RG, Laver WG, Air GM. Антигенная изменчивость среди вирусов гриппа типа А. В: Palese P, Kingsbury DW, редакторы. Генетика вирусов гриппа. Вена: Springer-Verlag; 1983. стр. 127–68. [Google Scholar]
27. Штайнхауэр Д.А. Роль расщепления гемагглютинина в патогенности вируса гриппа. Вирусология. 1999 г., 25 мая; 258 (1): 1–20. [PubMed] [Google Scholar]
28. Sieczkarski SB, Whittaker GR. Вирусный вход. Курр Топ Микробиол Иммунол. 2005; 285:1–23. [PubMed] [Google Scholar]
29. Стегманн Т. Механизмы слияния мембран: парадигма гемагглютинина гриппа и ее значение для внутриклеточного слияния. Трафик. 2000 г., август; 1 (8): 598–604. [PubMed] [Академия Google]
30. Пинто Л.Х., Холсингер Л.Дж., Лэмб Р.А. Белок М2 вируса гриппа обладает активностью ионного канала. Клетка. 1992 г., 1 мая; 69 (3): 517–28. [PubMed] [Google Scholar]
Клетка. 1992 г., 1 мая; 69 (3): 517–28. [PubMed] [Google Scholar]
31. Wharton SA, Belshe RB, Skeheel JJ, Hay AJ. Роль белка вириона М2 в снятии оболочки вируса гриппа: специфическое снижение скорости слияния мембран между вирусом и липосомами амантадином. Джей Ген Вирол. 1994 г., апрель 75 (часть 4): 945–8. [PubMed] [Google Scholar]
32. Neirynck S, Deroo T, Saelens X, Vanlandschoot P, Jou WM, Fiers W. Универсальная вакцина против гриппа А на основе внеклеточного домена белка M2. Нат Мед. 1999 октября; 5 (10): 1157–1163. [PubMed] [Google Scholar]
33. Слепушкин В.А., Кац Дж.М., Блэк Р.А., Гэмбл В.К., Рота П.А., Кокс Н.Дж. Защита мышей от заражения вирусом гриппа А путем вакцинации белком М2, экспрессируемым бакуловирусом. вакцина. 1995;13(15):1399–402. [PubMed] [Google Scholar]
34. Мартин К., Хелениус А. Транспорт поступающих нуклеокапсидов вируса гриппа в ядро. Дж Вирол. 1991 г., январь; 65 (1): 232–44. [Бесплатная статья PMC] [PubMed] [Google Scholar]
35. Cros JF, Palese P. Перемещение вирусной геномной РНК в ядро и из ядра: вирусы гриппа, болезни Тогото и Борна. Вирус Рез. 2003 Сентябрь; 95(1–2):3–12. [PubMed] [Google Scholar]
Cros JF, Palese P. Перемещение вирусной геномной РНК в ядро и из ядра: вирусы гриппа, болезни Тогото и Борна. Вирус Рез. 2003 Сентябрь; 95(1–2):3–12. [PubMed] [Google Scholar]
36. Li X, Palese P. Характеристика сигнала полиаденилирования РНК вируса гриппа. Дж Вирол. 1994 г., февраль; 68 (2): 1245–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
37. Luo GX, Luytjes W, Enami M, Palese P. Сигнал полиаденилирования РНК вируса гриппа включает участок уридинов, за которым следует дуплекс РНК в виде ручки-ручки. Дж Вирол. 1991 июнь; 65 (6): 2861–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]
38. Robertson JS, Schubert M, Lazzarini RA. Сайты полиаденилирования мРНК вируса гриппа. Дж Вирол. 1981 апреля; 38 (1): 157–63. [Бесплатная статья PMC] [PubMed] [Google Scholar]
39. Круг РМ. Праймирование транскрипции РНК вируса гриппа кэпированными гетерологичными РНК. Курр Топ Микробиол Иммунол. 1981; 93: 125–49. [PubMed] [Google Scholar]
40. Bancroft CT, Parslow TG.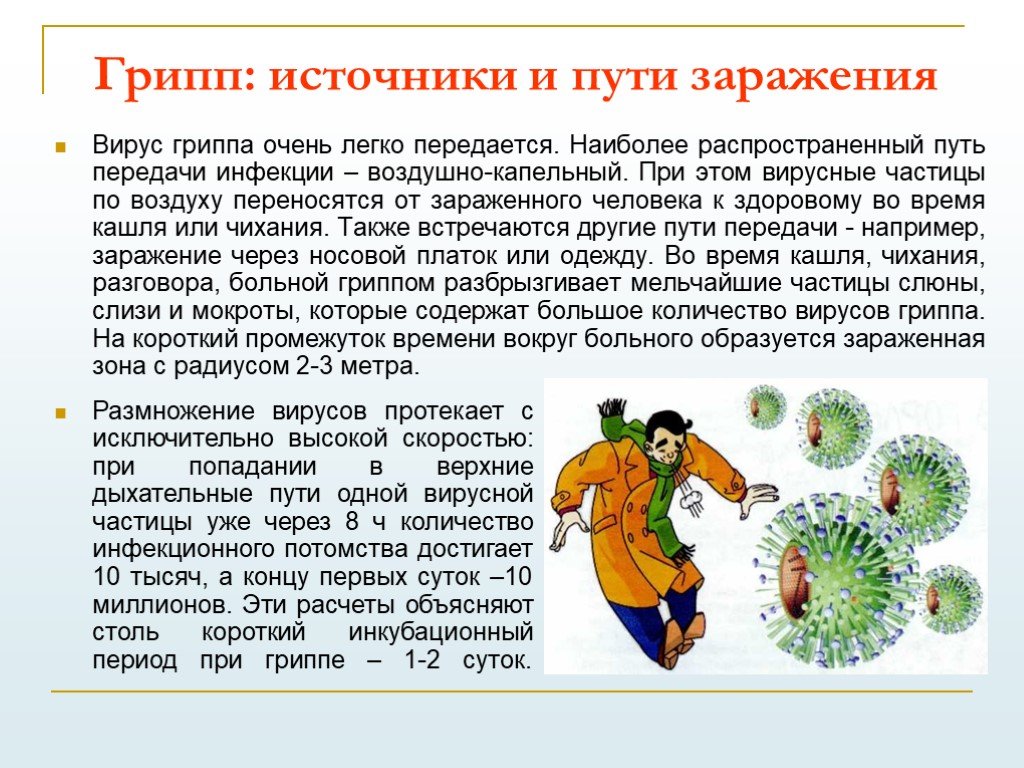 Доказательства сегментно-неспецифической упаковки генома вируса гриппа А. Дж Вирол. 2002 г., июль; 76 (14): 7133–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Доказательства сегментно-неспецифической упаковки генома вируса гриппа А. Дж Вирол. 2002 г., июль; 76 (14): 7133–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
41. Duhaut SD, Dimmock NJ. РНК с дефектом сегмента 1, которые мешают продукции инфекционного вируса гриппа А, требуют не менее 150 нуклеотидов 5′-последовательности: свидетельство системы, управляемой плазмидами. Джей Ген Вирол. 2002 г., февраль; 83 (часть 2): 403–11. [PubMed] [Академия Google]
42. Enami M, Sharma G, Benham C, Palese P. Вирус гриппа, содержащий девять различных сегментов РНК. Вирусология. 1991 ноябрь; 185 (1): 291–8. [PubMed] [Google Scholar]
43. Fujii Y, Goto H, Watanabe T, Yoshida T, Kawaoka Y. Селективное включение сегментов РНК вируса гриппа в вирионы. Proc Natl Acad Sci U S A. 2003 Feb 18;100(4):2002–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]
44. Colman PM, Varghese JN, Laver WG. Структура каталитических и антигенных участков нейраминидазы вируса гриппа. Природа. 1983 5–11 мая; 303 (5912): 41–4. [PubMed] [Google Scholar]
1983 5–11 мая; 303 (5912): 41–4. [PubMed] [Google Scholar]
45. Varghese JN, Laver WG, Colman PM. Структура нейраминидазы гликопротеинового антигена вируса гриппа с разрешением 2,9 Å. Природа. 1983 г., 5–11 мая; 303 (5912): 35–40. [PubMed] [Google Scholar]
46. Palese P, Compans RW. Ингибирование репликации вируса гриппа в культуре тканей 2-дезокси-2,3-дегидро-N-трифторацетилнейраминовой кислотой (FANA): механизм действия. Джей Ген Вирол. 1976 г., октябрь; 33 (1): 159–63. [PubMed] [Академия Google]
47. Палезе П., Тобита К., Уэда М., Компанс Р.В. Характеристика чувствительных к температуре мутантов вируса гриппа, дефектных по нейраминидазе. Вирусология. 1974 г., октябрь; 61 (2): 397–410. [PubMed] [Google Scholar]
48. Матросович М.Н., Матросович Т.Ю., Грей Т., Робертс Н.А., Кленк Х.Д. Нейраминидаза важна для инициации вирусной инфекции гриппа в эпителии дыхательных путей человека. Дж Вирол. 2004 г., ноябрь; 78 (22): 12665–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Обмен вирусами
- All topics »
- A
- B
- C
- D
- E
- F
- G
- H
- I
- J
- K
- L
- M
- N
- O
- P
- Q
- R
- S
- T
- U
- V
- W
- X
- Y
- Z
- Ресурсы »
- Бюллетени
- Факты в картинках
- Мультимедиа
- Публикации
- Вопросы и Ответы
- Инструменты и наборы инструментов
- Популярный »
- Загрязнение воздуха
- Коронавирусная болезнь (COVID-19)
- Гепатит
- оспа обезьян
- Все страны »
- A
- B
- C
- D
- E
- F
- G
- I H0103
- J
- K
- L
- M
- N
- O
- P
- Q
- R
- S
- T
- U
- V
- W
- X
- Y
- Z
- Регионы »
- Африка
- Америка
- Юго-Восточная Азия
- Европа
- Восточное Средиземноморье
- Западная часть Тихого океана
- ВОЗ в странах »
- Статистика
- Стратегии сотрудничества
- Украина ЧП
- все новости »
- Выпуски новостей
- Заявления
- Кампании
- Комментарии
- События
- Тематические истории
- Выступления
- Прожекторы
- Информационные бюллетени
- Библиотека фотографий
- Список рассылки СМИ
- Заголовки »
- Сосредоточиться на »
- Афганистан кризис
- COVID-19 пандемия
- Кризис в Северной Эфиопии
- Сирийский кризис
- Украина ЧП
- Вспышка оспы обезьян
- Кризис Большого Африканского Рога
- Последний »
- Новости о вспышках болезней
- Советы путешественникам
- Отчеты о ситуации
- Еженедельный эпидемиологический отчет
- ВОЗ в чрезвычайных ситуациях »
- Наблюдение
- Исследовать
- Финансирование
- Партнеры
- Операции
- Независимый контрольно-консультативный комитет
- Призыв ВОЗ о чрезвычайной ситуации в области здравоохранения 2023 г.

- Данные ВОЗ »
- Глобальные оценки здоровья
- ЦУР в области здравоохранения
- База данных о смертности
- Сборы данных
- Панели инструментов »
- Информационная панель COVID-19
- Приборная панель «Три миллиарда»
- Монитор неравенства в отношении здоровья
- Основные моменты »
- Глобальная обсерватория здравоохранения
- СЧЕТ
- Инсайты и визуализации
- Инструменты сбора данных
- Отчеты »
- Мировая статистика здравоохранения 2022 г.
- избыточная смертность от COVID
- DDI В ФОКУСЕ: 2022 г.
- О ком »
- Люди
- Команды
- Состав
- Партнерство и сотрудничество
- Сотрудничающие центры
- Сети, комитеты и консультативные группы
- Трансформация
- Наша работа »
- Общая программа работы
- Академия ВОЗ
- Деятельность
- Инициативы
- Финансирование »
- Инвестиционный кейс
- Фонд ВОЗ
- Подотчетность »
- Аудит
- Программный бюджет
- Финансовые отчеты
- Портал программного бюджета
- Отчет о результатах
- Управление »
- Всемирная ассамблея здравоохранения
- Исполнительный совет
- Выборы Генерального директора
- Веб-сайт руководящих органов
- Портал государств-членов
Обмен вирусами гриппа жизненно важен для глобальной готовности к пандемии. Обмен вирусами облегчает оценку риска пандемии, разработку вирусов-кандидатов для вакцин, обновление диагностических реагентов и тестовых наборов, а также эпиднадзор за устойчивостью к противовирусным препаратам.
Обмен вирусами облегчает оценку риска пандемии, разработку вирусов-кандидатов для вакцин, обновление диагностических реагентов и тестовых наборов, а также эпиднадзор за устойчивостью к противовирусным препаратам.
Обмен вирусами ГСЭГО
Обмен вирусами гриппа координируется Глобальной системой эпиднадзора за гриппом и ответных мер ВОЗ (ГСЭГО), международной сетью лабораторий по гриппу, которые проводят круглогодичный эпиднадзор за гриппом, оценивая риск пандемического гриппа и помогая в обеспечении готовности меры. ГСЭГО служит глобальным механизмом оповещения о появлении вирусов гриппа с пандемическим потенциалом.
Вспышки сезонного гриппа вызываются небольшими изменениями в уже циркулирующих вирусах, к которым у многих людей имеется некоторый иммунитет. Пандемия возникает, когда появляется вирус гриппа, против которого у большинства людей нет иммунитета, потому что он сильно отличается от любого предыдущего штамма у людей. Это позволяет штамму легко распространяться между людьми. Вирусы сезонного гриппа могут способствовать возникновению пандемического вируса; и как только будет установлен пандемический вирус, как в случае с пандемией A(h2N1) в 2009 г., он может стать сезонным вирусом.
Вирусы сезонного гриппа могут способствовать возникновению пандемического вируса; и как только будет установлен пандемический вирус, как в случае с пандемией A(h2N1) в 2009 г., он может стать сезонным вирусом.
В рамках Механизма ГПГ совместное использование биологических материалов для ГПГ в сети лабораторий ГСЭГО регулируется Стандартным соглашением о передаче материалов 1 (ССПМ1), которое устанавливает права и обязанности лабораторий ГСЭГО по многим вопросам, включая:
- передачу Биологические материалы для ГПГ внутри и для организаций за пределами ГСЭГО
- обращение с биологическими материалами для ГПГ
- использование механизма отслеживания вирусов гриппа
- исследования и публикации
- права интеллектуальной собственности
- разрешение споров
Механизм отслеживания вирусов гриппа
Механизм отслеживания вирусов гриппа (IVTM) – это общедоступная электронная интернет-система, которая регистрирует передачу и перемещение PIP биологических материалов в ГСЭГО ВОЗ, внутри и сторонам за пределами ГСЭГО ВОЗ.