Реестр лицензий Росздравнадзора на фармацевтическую деятельность
Реестр лицензий Росздравнадзора является одним из базовых механизмов защиты потребителей от оказания некачественных услуг. Он позволяет быстро проверить любую организацию на подлинность фармацевтической лицензии, получить основную информацию об организации.
Ведение реестра происходит на основе ФЗ №2343. Данный закон предусматривает следующие функции реестра:
-
Упрощение доступа к информации о компаниях и, как следствие, снижение нагрузки на органы Росздрава.
-
Поддержание высокого уровня актуальности информации.
-
Упрощение сбора информации из территориальных органов Росздрава.
-
Облегчение работы смежных органов власти.
-
Борьба с нелегальной деятельностью.

Это позволяет минимизировать риски, связанные с фармацевтическими и медицинскими организациями, которые работают без лицензии, на нелегальной основе. Получить доступ к информации можно буквально за несколько кликов, на официальном сайте Росздрава.
Документ важен не только для рядовых потребителей, но и для других компаний, которые специализируются на медицинской деятельности. Появляется возможность быстро проверить фармацевтическую организацию. Узнать, имеет ли она доступ к тем или иным видам услуг, может ли осуществлять оптовые поставки.
О каких компаниях можно узнать из реестра
Реестр лицензий на медицинскую деятельность и фармацевтику содержит в себе информацию о следующих компаниях:
-
розничные и оптовые аптеки;
-
частные клиники и медицинские кабинеты;
-
частные лаборатории;
-
фармацевтические склады и транспортные компании;
-
стоматологические кабинеты и клиники;
-
массажные и косметологические кабинеты.

Таким образом, в реестре фармацевтических лицензий Росздравнадзора содержатся данные о всех компаниях, которые проходили процедуру государственного лицензирования. Это касается не только организаций с действующей лицензией, но и тех, у которых лицензия была приостановлена или аннулирована.
ВАЖНО! Реестр является актуальным и достоверным источником информации. При необходимости, вы можете получить из него выписку об интересующей вас компании. Ее можно использовать в качестве документа для предоставления в те или иные государственные службы.
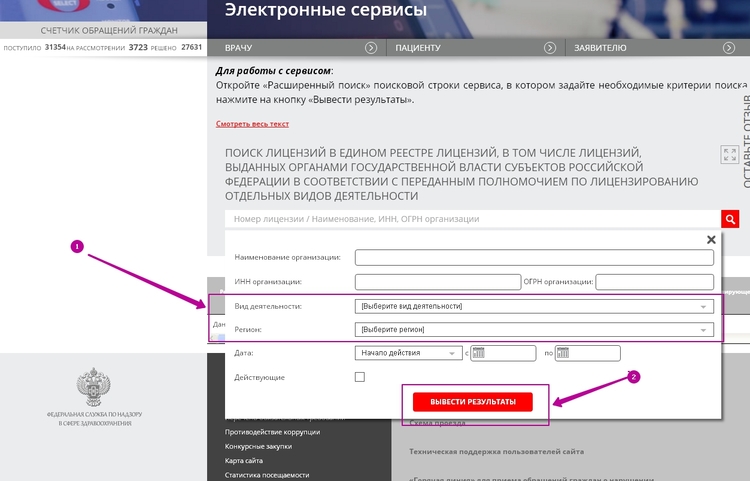
Работа с медицинским реестром
Получить доступ к реестру можно на официальном сайте Росздравнадзора. Для работы с ним необходимо вбить в строку поиска информацию об интересующей организации. Это может быть основная юридическая информация, название компании или информация об учредителе организации.
В открытом доступе представлена следующая информация о компаниях:
-
дата и номер регистрации;
-
номер лицензии, даты начала и окончания действия;
-
место нахождения компании-лицензиата;
-
наименование лицензирующего органа;
-
сведения о приостановке или аннулировании лицензии на фармацевтическую деятельность;
-
документ, подтверждающий наличие лицензии.
ВАЖНО! Если вы не смогли найти организацию в едином реестре, значит ее деятельность ведется на нелегальной основе. Это значит, что компания осуществляет свою деятельность без разрешения. Вероятнее всего: не имеет соответствующего технического оснащения и квалифицированных кадров.
Фармацевтическая лицензия
Единый реестр составлен на основе компаний, которые осуществляют фармацевтическую деятельность на основе мед. лицензии. Фармацевтическая лицензия — это разрешительный документ, который выдается государством. Он свидетельствует о том, что компания имеет все необходимое оборудование и достаточный штат квалифицированных кадров, чтобы оказывать один или несколько видов фармацевтических услуг. Для ее получения необходимо подготовить пакет документов, пройти проверки надзорных органов.
Фармацевтическая лицензия
Единый реестр составлен на основе компаний, которые осуществляют фармацевтическую деятельность на основе мед. лицензии. Фармацевтическая лицензия — это разрешительный документ, который выдается государством. Он свидетельствует о том, что компания имеет все необходимое оборудование и достаточный штат квалифицированных кадров, чтобы оказывать один или несколько видов фармацевтических услуг.
Выдачей лицензий занимается федеральная служба по надзору в сфере здравоохранения, входящая в состав Министерства здравоохранения России. Выдачей лицензии занимаются как федеральные, так и территориальные органы службы, в зависимости от конкретной ситуации.
Лицензия — это единый документ. Однако, каждый вид деятельности вписывается отдельно, имеет свою специфику. Лицензированию подлежит деятельность по перевозке, хранению, оптовой или розничной торговле, а также производству фармацевтической продукции и медицинских изделий.
Сроки выдачи лицензии во многом зависят от правильности заполнения документов и варьируются от сорока рабочих дней до четырех месяцев. Каждая неточность в бумагах может привести к задержке выдачи на срок до двух недель.
ВАЖНО! Несмотря на то, что лицензия действует бессрочно, она может быть отозвана или аннулирована в ходе плановых или внеплановых проверок.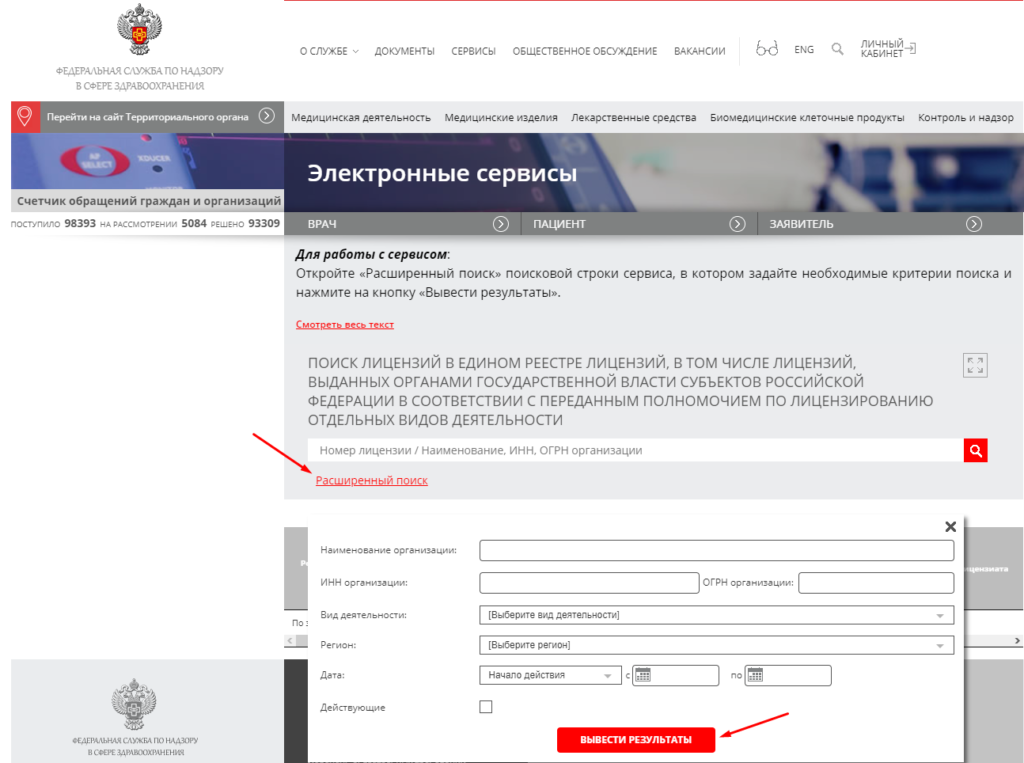
Предложение компании
Государственное лицензирование является сложным процессом, который требует от организации большого количества компетенций: знания профильного законодательства, норм по материалам отделки, меблировке и техническому оснащению помещений, правил работы.
Чтобы гарантированно получить лицензию на осуществление фармацевтической деятельности, стоит обратиться к специалистам. Компания КАСЛ более десяти лет занимается вопросами юридического консалтинга в сфере государственного лицензирования. Наши эксперты имеют огромный опыт в получении фармацевтических лицензий на весь перечень видов деятельности.
Обратившись в КАСЛ, вы получите лицензию с минимальными усилиями, сэкономив время и деньги, которые пришлось бы потратить на повторное оформление документов для получения лицензии.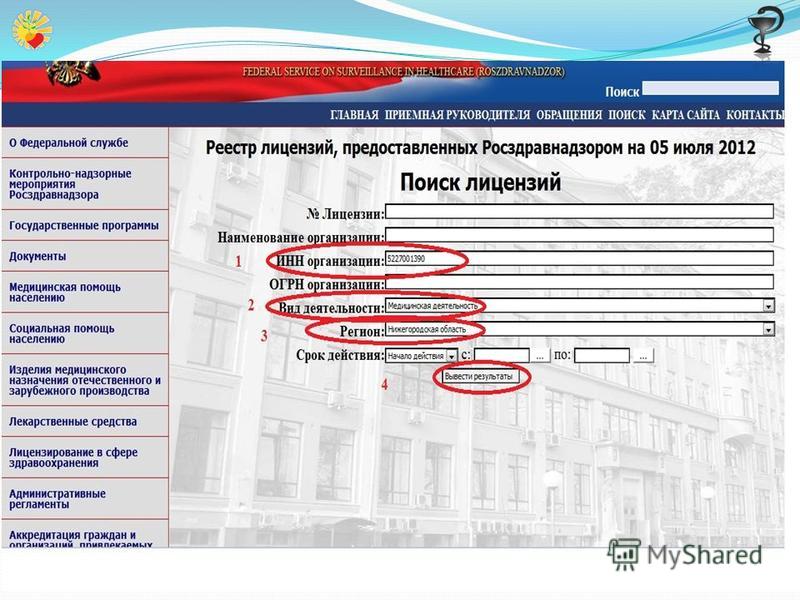
Карта сайта — Амбулаторно-поликлиническое медицинское учреждение
|
|
Регистрация медицинских изделий (Россия) — BEAWIRE
Регистрация медицинских изделий (Регистрация медицинских изделий в России) Медицинские изделия и изделия медицинского назначения находятся под контролем государства – Росздравнадзор (подразделение Минздрава, сокращенное наименование РЗН) контролирует обращение медицинских изделий на территории Российской Федерации. Как РЗН контролирует рынок медицинских изделий — вы можете узнать по ссылке (наблюдение за рынком).
Как РЗН контролирует рынок медицинских изделий — вы можете узнать по ссылке (наблюдение за рынком).
Зачем нужно свидетельство о регистрации?
Правительство контролирует индустрию здравоохранения и жизни пациентов.
Когда используется свидетельство о регистрации?
- Для таможенного оформления – при ввозе медицинского изделия
- Для реализации – больницы и медицинские организации не могли приобрести незарегистрированное медицинское изделие
- Для использования – больницы и медицинские организации не могут использовать незарегистрированное медицинское изделие
Как мне узнать, что мое устройство является медицинским?
Правила классификации изделий медицинского назначения являются основными критериями. Если ваше изделие включено в классификационные правила Росздравнадзора (номенклатурный код – часть Постановления Правительства РФ № 4н) – без сомнений, ваше изделие является изделием медицинского назначения. Если ваше изделие соответствует основному определению медицинского изделия, изложенному в приказе №1416, но для этого изделия отсутствует классификационный код, то это тоже медицинское изделие, и в процессе регистрации РЗН присвоит классификационный код этому типу изделия.
Если ваше изделие соответствует основному определению медицинского изделия, изложенному в приказе №1416, но для этого изделия отсутствует классификационный код, то это тоже медицинское изделие, и в процессе регистрации РЗН присвоит классификационный код этому типу изделия.
Как я могу начать процесс регистрации?
Отправьте нам описание продукта для предложения, свяжитесь с нами.
Что требуется для регистрации?
Полное техническое досье на продукцию – как основное требование. Без технических параметров устройства невозможно обеспечить процесс регистрации.
| Как выглядит процесс регистрации медицинского изделия?найти информацию по ссылке
Необходимые документы:
- Доверенность (спецпроект),
- Бизнес-лицензия для производственной компании,
- ISO 13485 или ISO 9001 (также может быть заменен другим документом),
- Сертификат CE (желательно, но не обязательное требование),
- Руководство пользователя,
- Техническое досье (техническая спецификация, файл управления рисками, клиническая оценка, отчет о валидации стерилизации и другие применимые характеристики для текущего продукта).

!!! Все документы должны быть легализованы в стране происхождения.
| Особенности государственной регистрации различных видов медицинских изделий
Ответ найти здесь
| Как обеспечивается процесс перевода и легализация?Найдите ответ здесь
| Информация об измерительных медицинских изделияхИзмерительные медицинские изделия требуют специальной дополнительной проверки при регистрации. Как узнать, что медицинский прибор измеряет медицинский прибор – найдите ответ здесь.
| Информация о клинических испытанияхТребуется ли тестирование каких пациентов? Как быть с клиническими исследованиями – по ссылке
| О владельце лицензииКто является владельцем лицензии? Пояснение к одной из самых горячих тем — по ссылке
| Регламент медицинского оборудования — дополнительная информация об утверждении
© Beawire — все права защищены, июль 2016 г.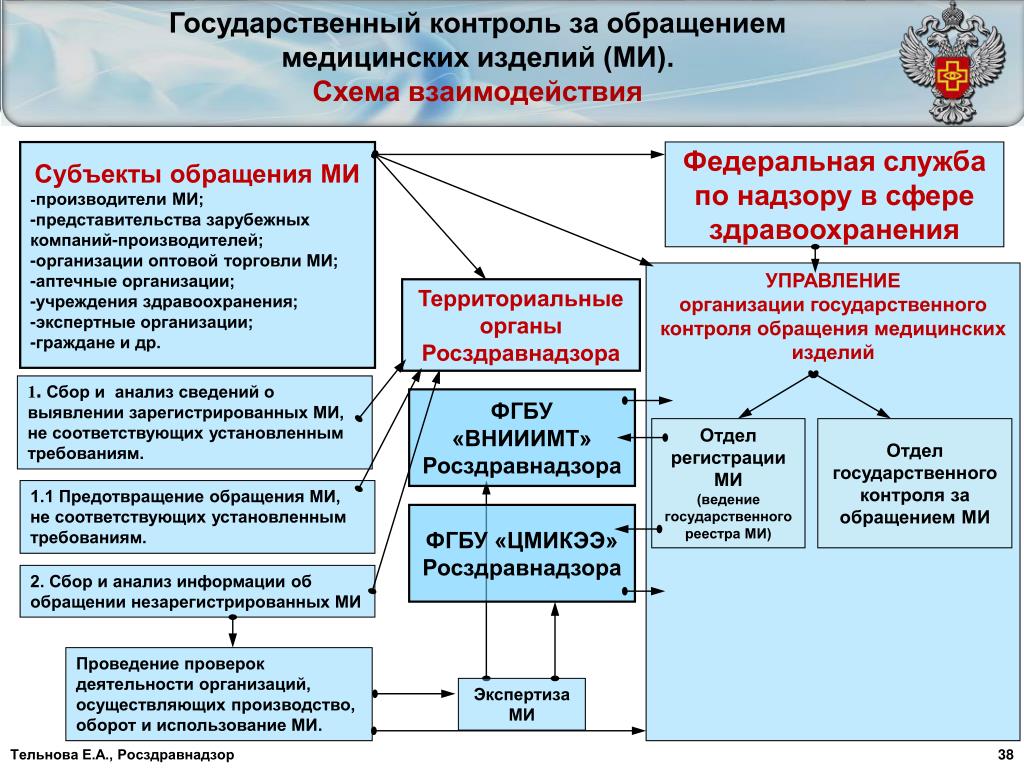 с обновлениями от мая 2019 г.
с обновлениями от мая 2019 г.
Регистрация медицинских изделий — официальная статистика за 2018 год Опубликовано
20 мая 2019 г.
Язык English
25 апреля в Федеральной службе по надзору в сфере здравоохранения (Росздравнадзор) состоялось заседание коллегии, на котором были подведены итоги работы в 2018 году, включая обнародование данных о регистрации медицинских изделий. С момента вступления в силу Постановления Правительства № 1416 в 2013 году количество зарегистрированных устройств сильно варьировалось от года к году, о чем мы говорили в прошлом году на конференции Raifarm 25 сентября (http://raifarm.com/news/press- релизы/регламент-медицинское-устройство-россия-еаэс).
Опубликованные данные Росздравнадзора доступны в видеоролике Сервиса (https://youtu.be/VYQOQS7_VvY).
Скриншот из видеопрезентации Росздравнадзора
Всего в 2018 году зарегистрировано 1342 изделия медицинского назначения, что на 61 изделие или на 5 % меньше, чем в 2017 году.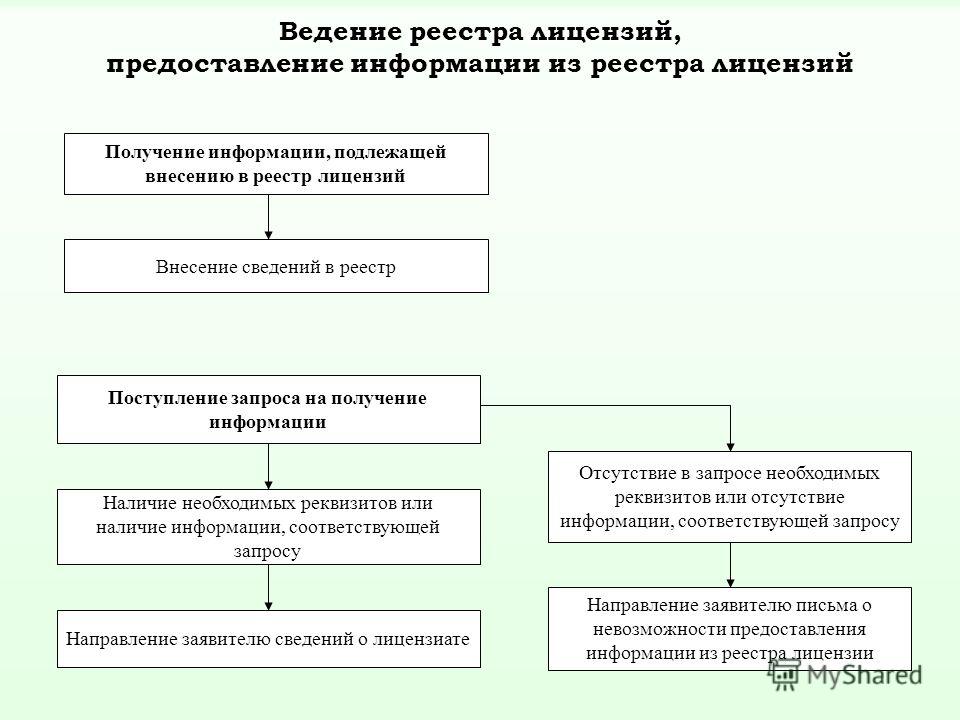 В 2017 году количество зарегистрированных изделий составило 62 изделия ( на 4,23%) ниже, чем в 2016 году. Тенденция количества зарегистрированных устройств снижается (обратите внимание на линию тренда на графике ниже). В этом случае линия тренда носит приблизительный характер и отражает прогноз на следующий период.
В 2017 году количество зарегистрированных изделий составило 62 изделия ( на 4,23%) ниже, чем в 2016 году. Тенденция количества зарегистрированных устройств снижается (обратите внимание на линию тренда на графике ниже). В этом случае линия тренда носит приблизительный характер и отражает прогноз на следующий период.
В видео не упоминаются причины снижения количества выданных регистрационных удостоверений, но можно предположить, что основной причиной является усложнение нормативных требований. Запросы экспертов на предоставление документации и информации продолжают усложняться и требуют значительных усилий для подготовки всеобъемлющего ответа.
Запросы касаются в первую очередь технической, эксплуатационной и нормативной документации, которая должна быть предоставлена с максимальной точностью. Несоответствия в технической документации, предоставленной производителями, являются еще одной причиной выдачи запросов. Заявителям приходится тратить значительное время на поиск таких несоответствий, которые могут возникать по разным причинам. Наиболее частые причины — это простые опечатки или случаи, когда производители поставляли документ на предыдущую версию медицинского изделия. Эксперты также часто выдают запросы на маркировку и упаковку устройств, а также требуют результаты испытаний на стабильность и старение для устройств с истекающим сроком годности. Специалисты по регулированию должны иметь постоянно растущие знания в этой области и учиться ориентироваться в запутанной паутине бюрократии в законодательстве, связанном с регистрацией.
Наиболее частые причины — это простые опечатки или случаи, когда производители поставляли документ на предыдущую версию медицинского изделия. Эксперты также часто выдают запросы на маркировку и упаковку устройств, а также требуют результаты испытаний на стабильность и старение для устройств с истекающим сроком годности. Специалисты по регулированию должны иметь постоянно растущие знания в этой области и учиться ориентироваться в запутанной паутине бюрократии в законодательстве, связанном с регистрацией.
Скриншот из видеопрезентации Росздравнадзора
Соотношение отечественных и зарубежных медицинских изделий составляет 60%/40% соответственно. В абсолютном выражении это составляет 805 регистрационных удостоверений, выданных на отечественную продукцию, и 537 свидетельств на импортную продукцию. В ролике не приводится информация о количестве зарегистрированных медицинских изделий по классам риска.
В 2018 году, согласно официальной базе данных Росздравнадзора, всего выдано 336 регистрационных удостоверений (25 % от общего количества свидетельств) на зарубежные и отечественные приборы I класса, 517 регистрационных удостоверений (39%) для устройств класса IIa, 336 сертификатов (25%) для устройств класса IIb и 153 сертификата (11%) для устройств класса III.
Обращает на себя внимание также снижение количества отказов в регистрации на 38% в 2018 г. по сравнению с 2017 г., хотя, вероятно, это связано с тем, что многие регистрационные досье возвращаются заявителям на первом этапе рассмотрения до достижения «основной экспертизы», а не эффективности новых «упрощений» Росздравнадзора. Например, можно вспомнить недавние жалобы некоторых заявителей на просьбы о предоставлении лицензионных договоров на товарные знаки, что в ряде случаев просто невозможно. То же самое и с запросами, связанными с отдельными аспектами устройств и хозяйственной деятельностью компаний, что сбивает с толку многих иностранных производителей. В обоих случаях процесс регистрации заходит в тупик, и файл заявки возвращается заявителю. Возврат документов таким способом не считается отказом в регистрации.
На приведенной ниже диаграмме показано количество регистрационных удостоверений, выданных с 2007 по 2018 год, с разбивкой по отечественным и зарубежным устройствам.