Утилизация шприцов и игл одноразового использования при помощи электромеханических деструкторов
Главная → О компании → Статьи
Опубликовано: 03 июня 2019
Изменено: 30 ноября 2022
Риск получения травм при сборе, транспортировке и утилизации инъекционных шприцов однократного применения остается достаточно высоким даже при соблюдении всех мер предосторожности.
Одноразовые шприцы относятся к медицинским отходам классов «Б» и «В». Игла — самый опасный элемент, поскольку напрямую контактирует с кровью пациентов.
Алгоритм утилизации шприцев и игл состоит из нескольких этапов, на каждом из которых персонал подвергается определенному риску получения травм и заражения. Острый стальной наконечник иглы способен проткнуть не только одноразовую медицинскую перчатку, но и прочный контейнер из пластика.
Единственным способом снижения рисков для персонала, контактирующего с медицинскими отходами, считается сокращение времени между использованием и утилизацией одноразовых шприцев и игл и минимизация физического контакта с ними.
В действующей редакции СанПиН прописаны требования к утилизации одноразовых шприцов после инъекции. Медработник должен использовать иглосъемник, деструктор или любое другое приспособление для безопасного отделения иглы от канюли. Делать это вручную или надевать колпачок на использованный шприц запрещено. Даже квалифицированный медик может случайно поранить палец и занести инфекцию.
Деструктор представляет собой компактное устройство, которое размещают в манипуляционном кабинете. Он служит для обеззараживания, уничтожения, утилизации шприцов и игл сразу же после использования. Устройство соответствует требованиям СанПиН, отличается безопасностью в применении. Существуют два вида деструкторов:
- Механические. Металлическая игла разрушается при помощи ножей, скрытых под корпусом. Недостаток такого устройства состоит в том, что биологические материалы, попавшие в деструктор, не обрабатываются, а сопло остается острым. Медработник может получить травму при извлечении контейнера с отходами.
- Электрические. Принцип работы устройства состоит в сжигании иглы. На нее подается высокое напряжение, которое полностью расплавляет металл. Температура при этом превышает отметку 1000 °C, что приводит к полному обеззараживанию отходов.
Сфера применения деструкторов:
- государственные стационары и амбулатории;
- лабораторные учреждения;
- частные клиники;
- стоматологические клиники;
- косметологические салоны;
- ветеринарные клиники;
- клиники нетрадиционной медицины.
Уничтожение одной иглы в электрическом деструкторе занимает несколько секунд в зависимости от ее диаметра и мощности трансформатора.
Срезание канюли выполняется механически. Нож гильотины приводится в движение простым нажатием на рычаг. Оставшаяся пластиковая часть шприца может быть утилизирована как ТБО.
Особенности конструкции и преимущества деструктора шприцев и игл
Компания «Листон» — производитель надежных, функциональных и безопасных электротермических деструкторов, предназначенных для уничтожения шприцов и игл сразу же после инъекции.
Деструктор игл Liston D 1101 создан для оснащения перевязочных, прививочных, операционных помещений в медицинских учреждениях. Он снижает риск инфицирования персонала при контакте с иглой и исключит возможность повторного использования одноразовых шприцев.
Прибор для утилизации игл и шприцев состоит из следующих элементов:
- Корпус из нержавеющей стали. Прочность, долговечность, коррозионная стойкость и простота в уходе — основные преимущества использования «нержавейки» в медицинских приборах.
Мощный трансформатор. Игла полностью сжигается при помощи электрической дуги. При этом погибают все известные микроорганизмы и происходит полное разложение органики. Устройство рассчитано на уничтожение игл с типоразмерами 18-31G (диаметром до 1 мм). - Надежная контактная группа. Во время работы деструктора сгорает игла.
- Контейнер для отходов деструкции. Остатки расплавленных игл собираются в лоток в течение всего рабочего дня.
- Гильотина для отрезания канюли. Острый нож срезает этот элемент, чтобы исключить возможность повторного использования шприца.
 Корпус и электрическая часть оснащены защитой, исключающей получение травмы работником или повреждение самого прибора.
Корпус и электрическая часть оснащены защитой, исключающей получение травмы работником или повреждение самого прибора.
Заказать деструктор Liston D1101 и другое оборудование нашего производства можно на сайте. Сотрудники помогут подобрать модель в соответствии с поставленными задачами и бюджетом. Для получения развернутой консультации свяжитесь с нами посредством формы обратной связи или по бесплатному телефону горячей линии 8(800) 350-40-41.
словарь терминов
Автор статей, редактор — Сапрыгин Юрий Сергеевич
Предыдущая статья
Следующая статья
Лабораторное оборудование Liston
Деструктор игл Liston D 1101
подробнееДистиллятор Liston A 1204
подробнееДистиллятор Liston A 1210
Вернуться к списку статей
СанПин Медицинские Отходы Беларусь Постановление МЗРБ 14
НА ОСНОВАНИИ СТАТЬИ 13 ЗАКОНА РЕСПУБЛИКИ БЕЛАРУСЬ ОТ 7 ЯНВАРЯ 2012 ГОДА «О САНИТАРНО-ЭПИДЕМИОЛОГИЧЕСКОМ БЛАГОПОЛУЧИИ НАСЕЛЕНИЯ», АБЗАЦА ВТОРОГО ПОДПУНКТА 8. 32 ПУНКТА 8 ПОЛОЖЕНИЯ О МИНИСТЕРСТВЕ ЗДРАВООХРАНЕНИЯ РЕСПУБЛИКИ БЕЛАРУСЬ, УТВЕРЖДЕННОГО ПОСТАНОВЛЕНИЕМ СОВЕТА МИНИСТРОВ РЕСПУБЛИКИ БЕЛАРУСЬ ОТ 28 ОКТЯБРЯ 2011 Г. № 1446 «О НЕКОТОРЫХ ВОПРОСАХ МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ И МЕРАХ ПО РЕАЛИЗАЦИИ УКАЗА ПРЕЗИДЕНТА РЕСПУБЛИКИ БЕЛАРУСЬ ОТ 11 АВГУСТА 2011 Г. № 360»,
32 ПУНКТА 8 ПОЛОЖЕНИЯ О МИНИСТЕРСТВЕ ЗДРАВООХРАНЕНИЯ РЕСПУБЛИКИ БЕЛАРУСЬ, УТВЕРЖДЕННОГО ПОСТАНОВЛЕНИЕМ СОВЕТА МИНИСТРОВ РЕСПУБЛИКИ БЕЛАРУСЬ ОТ 28 ОКТЯБРЯ 2011 Г. № 1446 «О НЕКОТОРЫХ ВОПРОСАХ МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ И МЕРАХ ПО РЕАЛИЗАЦИИ УКАЗА ПРЕЗИДЕНТА РЕСПУБЛИКИ БЕЛАРУСЬ ОТ 11 АВГУСТА 2011 Г. № 360»,
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РЕСПУБЛИКИ БЕЛАРУСЬ ПОСТАНОВЛЯЕТ:
1. УТВЕРДИТЬ ПРИЛАГАЕМЫЕ САНИТАРНЫЕ НОРМЫ И ПРАВИЛА «САНИТАРНО-ЭПИДЕМИОЛОГИЧЕСКИЕ ТРЕБОВАНИЯ К ОБРАЩЕНИЮ С МЕДИЦИНСКИМИ ОТХОДАМИ».
2. ПРИЗНАТЬ УТРАТИВШИМИ СИЛУ:
ПОСТАНОВЛЕНИЕ ГЛАВНОГО ГОСУДАРСТВЕННОГО САНИТАРНОГО ВРАЧА РЕСПУБЛИКИ БЕЛАРУСЬ ОТ 20 ОКТЯБРЯ 2005 Г. № 147 «ОБ УТВЕРЖДЕНИИ САНИТАРНЫХ ПРАВИЛ И НОРМ 2.1.7.14-20-2005
«ПРАВИЛА ОБРАЩЕНИЯ С МЕДИЦИНСКИМИ ОТХОДАМИ»;
ПОСТАНОВЛЕНИЕ МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ РЕСПУБЛИКИ БЕЛАРУСЬ ОТ 1 ДЕКАБРЯ 2008 Г. № 207 «О ВНЕСЕНИИ ИЗМЕНЕНИЙ И ДОПОЛНЕНИЙ В САНИТАРНЫЕ ПРАВИЛА И НОРМЫ 2.1.7.14-20-2005 «ПРАВИЛА ОБРАЩЕНИЯ С МЕДИЦИНСКИМИ ОТХОДАМИ».
3. НАСТОЯЩЕЕ ПОСТАНОВЛЕНИЕ ВСТУПАЕТ В СИЛУ ЧЕРЕЗ ПЯТНАДЦАТЬ РАБОЧИХ ДНЕЙ ПОСЛЕ ЕГО ОФИЦИАЛЬНОГО ОПУБЛИКОВАНИЯ.
МИНИСТР В.А.МАЛАШКО
УТВЕРЖДЕНО
ПОСТАНОВЛЕНИЕ МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ РЕСПУБЛИКИ БЕЛАРУСЬ
07.02.2018 № 14
ГЛАВА 1 ОБЩИЕ ПОЛОЖЕНИЯ
1.Настоящие Санитарные нормы и правила устанавливают санитарно- эпидемиологические требования к дезинфекции, сбору, удалению отработанных медицинских изделий, крови, иных биологических жидкостей, а также к сбору, временному хранению медицинских отходов охраны здоровья людей (далее – медицинские отходы) в организациях всех форм собственности и у индивидуальных предпринимателей, оказывающих медицинскую помощь (далее – организация).
2.Настоящие Санитарные нормы и правила не распространяются на:
отходы, отнесенные в соответствии с законодательством Республики Беларусь к коммунальным отходам;
радиоактивные отходы; ртутьсодержащие отходы;
лекарственные средства, за исключением остатков цитостатических лекарственных средств и медицинских изделий, образовавшихся в организациях при приготовлении и использовании цитостатических лекарственных средств (далее – ЦЛС).
3.Для целей настоящих Санитарных норм и правил используются основные термины и их определения в значениях, установленных Законом Республики Беларусь от 18 июня 1993 года «О здравоохранении», Законом Республики Беларусь от 20 июля 2007 года «Об обращениях с отходами» , Законом Республики Беларусь от 7 января 2012 года «О санитарно-эпидемиологическом благополучии населения», а также следующие термины и их определения:
дезинфекция отработанных медицинских изделий – уничтожение патогенных и условно-патогенных микроорганизмов (вирусов, бактерий, грибов) химическим, физическим, комбинированным и другими методами;
медицинские отходы – отработанные медицинские изделия, прошедшие дезинфекцию, биологический материал, образовавшийся после проведения медицинских вмешательств, а также остатки биологического материала после отбора биопсийного, секционного материала для патологоанатомических исследований;
отработанные медицинские изделия – одноразовые и многоразовые (не подлежащие дальнейшему использованию) медицинские изделия, образовавшиеся в организациях при приготовлении и использовании цитостатических лекарственных средств, загрязненные кровью, иными биологическими жидкостями и (или) контактировавшие со слизистой оболочкой и (или) поврежденной кожей организма человека;
тара для отработанных медицинских изделий, крови, иных биологических жидкостей, медицинских отходов, ЦЛС (далее – тара) – элемент упаковки, предназначенный для размещения отработанных медицинских изделий, крови, иных биологических жидкостей, ЦЛС, медицинских отходов (емкости, контейнеры, пакеты).
4.Настоящие Санитарные нормы и правила обязательны для соблюдения государственными органами, иными организациями, физическими лицами, в том числе индивидуальными предпринимателями.
5.Государственный санитарный надзор за соблюдением настоящих Санитарных норм и правил осуществляется в порядке, установленном законодательством Республики Беларусь.
6.За нарушение настоящих Санитарных норм и правил виновные лица несут ответственность в соответствии с законодательством Республики Беларусь.
ГЛАВА 2
САНИТАРНО-ЭПИДЕМИОЛОГИЧЕСКИЕ ТРЕБОВАНИЯ К ДЕЗИНФЕКЦИИ ОТРАБОТАННЫХ МЕДИЦИНСКИХ ИЗДЕЛИЙ
7.Отработанные медицинские изделия должны подвергаться дезинфекции в соответствии с законодательством Республики Беларусь.
8.Для проведения дезинфекции отработанных медицинских изделий должны использоваться средства дезинфекции или установки, предназначенные для этих целей, в соответствии с законодательством Республики Беларусь и рекомендациями их производителей.
9.Сточные воды, образовавшиеся в результате дезинфекции отработанных медицинских изделий растворами средств дезинфекции, приготовленными в соответствии с рекомендациями производителей путем разбавления водой (в пропорции не менее чем 1:1), допускается отводить (сбрасывать) в централизованные системы водоотведения (канализацию).
10.При использовании установок с паровым или другим методом дезинфекции, установок по сжиганию предварительная дезинфекция отработанных медицинских изделий химическим методом не проводится.
11.При использовании установки с паровым или другим методом дезинфекции регистрация процедуры дезинфекции должна проводиться с указанием режима дезинфекции, даты и времени начала и окончания процесса дезинфекции, названия структурного подразделения, из которого доставлены на дезинфекцию отработанные медицинские изделия. Результаты документирования процедуры дезинфекции должны сохраняться в течение одного года после процесса дезинфекции.
12.Транспортировка не прошедших дезинфекцию отработанных медицинских изделий из структурных подразделений, из организации, с места оказания медицинской помощи вне организации в помещение или на объект, где организована их дезинфекция, должна проводиться в условиях, исключающих их непосредственный контакт с работниками и пациентами:
в одноразовой и (или) в непрокалываемой многоразовой таре в зависимости от морфологического состава отработанных медицинских изделий с маркировкой (отработанные медицинские изделия, название структурного подразделения, дата сбора отработанных медицинских изделий в тару). Одноразовая тара (пакеты) должна располагаться внутри многоразовой тары;
Одноразовая тара (пакеты) должна располагаться внутри многоразовой тары;
в непрокалываемой одноразовой таре, снабженной плотно прилегающей крышкой и (или) иглосъемниками для сбора острых, колющих и режущих отработанных медицинских изделий.
13.Дезинфекция непрокалываемой многоразовой тары для сбора отработанных медицинских изделий должна проводиться после каждого ее опорожнения.
ГЛАВА 3
САНИТАРНО-ЭПИДЕМИОЛОГИЧЕСКИЕ ТРЕБОВАНИЯ К СБОРУ, ДЕЗИНФЕКЦИИ И УДАЛЕНИЮ КРОВИ, ИНЫХ БИОЛОГИЧЕСКИХ ЖИДКОСТЕЙ В ОРГАНИЗАЦИИ
14.Кровь, образовавшаяся после лечебно-диагностических процедур, должна: собираться в непрокалываемую влагостойкую тару с крышкой, исключающей самопроизвольное вскрытие и обеспечивающей при транспортировке герметизацию тары; дезинфицироваться средствами дезинфекции в соответствии с рекомендациями их производителей.
15.Сточные воды, образовавшиеся в результате дезинфекции крови растворами средств дезинфекции, приготовленными в соответствии с рекомендациями производителей путем разбавления водой (в пропорции не менее чем 1:1), допускается отводить (сбрасывать) в централизованные системы водоотведения (канализацию).
16.Иные биологические жидкости организма человека перед отведением (сбросом) в централизованные системы водоотведения (канализацию) дезинфекции не подлежат.
ГЛАВА 4
САНИТАРНО-ЭПИДЕМИОЛОГИЧЕСКИЕ ТРЕБОВАНИЯ К СБОРУ, ВРЕМЕННОМУ ХРАНЕНИЮ И УНИЧТОЖЕНИЮ ЦИТОСТАТИЧЕСКИХ ЛЕКАРСТВЕННЫХ СРЕДСТВ В ОРГАНИЗАЦИИ
17.Сбор ЦЛС должен осуществляться в герметичную одноразовую тару.
18.Временное хранение герметичной одноразовой тары с ЦЛС должно осуществляться в специальном помещении организации в условиях, исключающих прямой контакт с ЦЛС пациентов и работников.
19.Уничтожение ЦЛС проводится с использованием высокотемпературных технологий в соответствии с законодательством Республики Беларусь.
ГЛАВА 5
САНИТАРНО-ЭПИДЕМИОЛОГИЧЕСКИЕ ТРЕБОВАНИЯ К СБОРУ И ВРЕМЕННОМУ ХРАНЕНИЮ МЕДИЦИНСКИХ ОТХОДОВ И БИОЛОГИЧЕСКОГО МАТЕРИАЛА В ОРГАНИЗАЦИИ
20.Для сбора медицинских отходов должны использоваться: одноразовая и (или) непрокалываемая многоразовая тара в зависимости от морфологического состава медицинских отходов и условий для их удаления в организации и за ее пределами. Одноразовая тара (пакеты) должна располагаться внутри многоразовой тары;
Одноразовая тара (пакеты) должна располагаться внутри многоразовой тары;
непрокалываемая одноразовая тара, снабженная плотно прилегающей крышкой и (или) иглосъемниками для сбора острых, колющих и режущих медицинских отходов.
21.Одноразовая тара с медицинскими отходами, подготовленная к транспортировке из структурного подразделения организации, должна иметь маркировку с названием структурного подразделения, датой сбора медицинских отходов в тару.
22.Маркировка одноразовой тары с медицинскими отходами, подготовленной к транспортировке из организации, не проводится.
23.Для сбора медицинских отходов и их транспортировки в структурных подразделениях и за их пределами допускается использовать тележки, предназначенные для этих целей.
24.В организации (структурных подразделениях) для упорядоченного временного хранения медицинских отходов должны быть созданы условия, исключающие прямой контакт с медицинскими отходами пациентов и работников (специально выделенное место, помещение, шкаф или другое).
25.Выделение из медицинских отходов вторичных материальных ресурсов в организациях (структурных подразделениях) для пациентов с инфекционными заболеваниями, представляющими или могущими представлять собой чрезвычайную ситуацию в области общественного здравоохранения, имеющую международное значение, при работах с условно-патогенными микроорганизмами и патогенными биологическими агентами, а также в патологоанатомических организациях (структурных подразделениях) не допускается.
26.Работы с медицинскими отходами должны проводиться с использованием средств индивидуальной защиты.
27.Временное хранение в организации тары с биологическим материалом должно проводиться в специально выделенном холодильном (морозильном) оборудовании, за исключением удаленных зубов и их остатков.
28.После проведения медицинских вмешательств и отбора биопсийного, секционного материала для патологоанатомических исследований биологический материал подлежит сжиганию и (или) захоронению в соответствии с требованиями законодательства Республики Беларусь. Дезинфекция биологического материала растворами средств дезинфекции перед сжиганием, захоронением не проводится.
Дезинфекция биологического материала растворами средств дезинфекции перед сжиганием, захоронением не проводится.
инноваций отвечают растущему спросу на предварительно заполненные шприцы
Опубликовано:
Hallie Forcinio
Biopharm International , Biopharm International-06-2021, том 34, выпуск 6
Page: 32–201-2021, том 34, выпуск 6
9Page: 32–01-2021, том 34, выпуск 6
9: 35
Инновационные контейнеры и оборудование расширяют возможности применения.
Предварительно наполненные шприцы продолжают развиваться, чтобы улучшить работу, повысить автоматизацию линии наполнения/завершения и повысить производительность и производительность. Инновации в области шприцев также повышают безопасность и эффективность пациентов и лиц, осуществляющих уход, и сокращают отходы продукции и упаковочных материалов. «Поскольку он уже упакован и готов к инъекции, предварительно заполненный шприц экономит время и позволяет избежать ненужных манипуляций до фактического применения, сводя к минимуму риск ошибок при инъекции, ошибок разбавления или проблем с нестерильностью [которые представляют риск] -дозовые контейнеры», — объясняет Венцель Новак, старший директор по глобальному развитию бизнеса Gerresheimer Medical Systems.
По оценкам Новака, на предварительно заполненные шприцы в настоящее время приходится 10–15% парентерального рынка, и ожидается рост спроса. Исследование рынка, проведенное Emergen Research, прогнозирует, что продажи предварительно заполненных шприцев будут увеличиваться в среднем на 8,9% в год в период с 2019 по 2027 год, а к 2027 году они увеличатся почти вдвое и составят 9,11 млрд долларов США (1). Движущие силы включают производство вакцин, а также принятие самостоятельного введения биопрепаратов для лечения хронических заболеваний, таких как диабет и аутоиммунные заболевания (1).
«Если вы посмотрите на 40 самых популярных инъекционных продуктов, все они используются с предварительно заполненными шприцами», — сообщает д-р Николя Брандес, директор по управлению продуктами, полимерные предварительно заполненные шприцы и флаконы в West Pharmaceutical Services.
Предварительно заполненные шприцы могут быть изготовлены из стекла или пластика, например, из циклического полимера олефина/сополимера циклического олефина (COP/COC) или полипропилена (PP). Стекло доминирует на большинстве рынков. Новак прогнозирует, однако, что доля предварительно наполненных шприцев COP/COC, изготовленных методом совместного литья под давлением, вырастет с 2% до более чем 5% в течение следующего десятилетия.
Стекло доминирует на большинстве рынков. Новак прогнозирует, однако, что доля предварительно наполненных шприцев COP/COC, изготовленных методом совместного литья под давлением, вырастет с 2% до более чем 5% в течение следующего десятилетия.
«Мы получили больше разрешений на продукцию из пластмасс, особенно за последние пять лет», — сообщает Брандес. Он отмечает, что пластиковые шприцы часто выбирают для конкретных применений, таких как контрастные вещества для визуализации, гиалуроновая кислота и ботокс, а также для продуктов, чувствительных к силиконовому маслу. Пластиковые шприцы также хорошо работают в автоинжекторах.
По словам Новака, около 60% предварительно заполненных шприцев представляют собой шприцы со вставными иглами, но существуют значительные региональные различия. Наиболее распространенные предварительно заполненные шприцы имеют длину 1 мл и короткую емкость 1 мл. Наиболее распространенные области применения включают антикоагулянты (стекло объемом 1 мл), вакцины (стекло объемом 1 мл, короткое) и изотонические растворы, где предпочтительным материалом является полипропилен. «При существующем COVID-19вызов, во всем мире ожидается значительное увеличение количества вакцин», — говорит Новак. Этот рост будет связан с вакцинами против COVID-19, а также с повышенным интересом к известным вакцинам (например, от гриппа).
«При существующем COVID-19вызов, во всем мире ожидается значительное увеличение количества вакцин», — говорит Новак. Этот рост будет связан с вакцинами против COVID-19, а также с повышенным интересом к известным вакцинам (например, от гриппа).
Шприцы для предварительного наполнения поставляются россыпью или готовыми к заполнению (RTF). Шприцы Gerresheimer поставляются в виде нестерилизованных стеклянных корпусов в плоских (Rondo) лотках или в индивидуальной упаковке (например, в пакетах). Его шприцы Gx RTF представлены в виде промытых, стерилизованных компонентов RTF для фармацевтических и контрактных производств и доступны в стекле или пластике. Объемы заполнения варьируются от 0,5 до 5,0 мл, причем наиболее распространенные объемы составляют от 0,5 мл до 3,0 мл.
Инновации в области предварительно наполненных шприцев
Инновации от поставщиков подчеркивают простоту использования предварительно заполненных шприцев и делают акцент на добавлении размеров (особенно для больших объемов), сокращении отходов, а также комфорте и безопасности пациентов и лиц, осуществляющих уход.
Компания Gerresheimer расширила ассортимент предварительно наполняемых полимерных шприцев для чувствительных биологических препаратов, биоаналогов и биопрепаратов, включив в него игольчатый шприц Gx RTF ClearJect COP с коннектором Люэра объемом 1,0 мл.
Компания West Pharmaceutical Services расширила ассортимент, включив в него шприцы со вставными иглами (пластиковая версия стеклянного шприца со вставленной иглой), а также иглы большего размера и варианты объема продукции. «За последние три-пять лет мы получили больше разрешений на более крупный формат 2,5 мл», — сообщает Брандес. Больший объем уменьшает количество шприцев, необходимых для одной дозы, и повышает эффективность и удобство. Также есть тенденция к более тонким иглам. «Меньшие и тонкие иглы означают меньше боли», — объясняет он.
Удобство использования — это цель сотрудничества между Gerresheimer и Stevanto Group, в рамках которой Stevanato поставляет свою систему укупорки ITC для шприцев Gerresheimer Gx RTF с люэровским замком.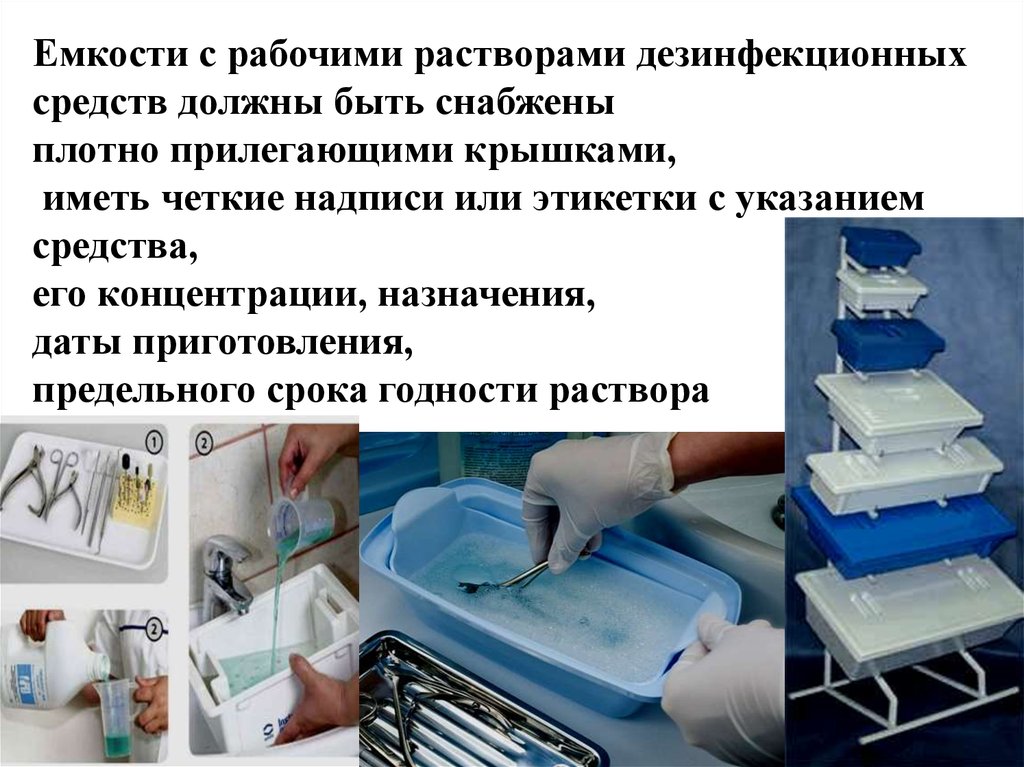 Встроенный уплотнительный колпачок состоит из эластомерного компонента, доступного в различных составах, и жесткого полупрозрачного полимерного колпачка. Преимущества включают большую стабильность и защиту на срок годности по сравнению с традиционными системами конусов Люэра (2).
Встроенный уплотнительный колпачок состоит из эластомерного компонента, доступного в различных составах, и жесткого полупрозрачного полимерного колпачка. Преимущества включают большую стабильность и защиту на срок годности по сравнению с традиционными системами конусов Люэра (2).
Предварительно заполненные шприцы обладают преимуществами устойчивого развития за счет отказа от многодозовых флаконов и связанного с ними производства и обработки, а также отходов продукта, связанных с остатками продукта. Тем не менее, говорит Брандес, «есть много возможностей для улучшения. Нынешние системы создают много отходов». Но предпринимаются усилия по снижению количества брака и переработке ванн, в которых находятся вложенные друг в друга контейнеры, во время процесса наполнения/окончания.
Чтобы соответствовать приоритету безопасности продукции, поставщики ищут конструкции, предотвращающие травмы от укола иглой и защищающие качество продукции за счет сведения к минимуму твердых частиц и исключения взаимодействия продукта с остатками вольфрама или силикона. Для продуктов, чувствительных к вольфраму, компания Gerresheimer Biological Solutions предлагает изготовленный из неметаллических материалов шприц. Благодаря этой запатентованной технологии штифт, используемый для придания конической формы, изготавливается из керамики, а не из вольфрама или другого металла.
Для продуктов, чувствительных к вольфраму, компания Gerresheimer Biological Solutions предлагает изготовленный из неметаллических материалов шприц. Благодаря этой запатентованной технологии штифт, используемый для придания конической формы, изготавливается из керамики, а не из вольфрама или другого металла.
Силиконовое масло обычно используется для улучшения работы шприцев, но может вызывать проблемы агрегации и образования частиц для чувствительных биологических препаратов. «Офтальмологи и регулирующие органы стремятся отказаться от силиконизированных форматов», — сообщает Брандес. «У некоторых пациентов возникают реакции на силикон, и со временем при повторных инъекциях материал может накапливаться [в глазу]», — объясняет он.
Один вариант без силикона сочетает в себе плунжеры ImproJect от W.L. Gore & Associates с шприцами syriQ BioPure без силикона от SCHOTT. Система открывает дверь для многих чувствительных продуктов, чтобы перейти в формат предварительно заполненных шприцев. До появления дизайна без силикона «фармацевтические производители, стремящиеся избежать вызванной силиконом агрегации и невидимых частиц, должны были выбирать флаконы, даже если они хотели предложить другие варианты доставки», — сказала Кристиан Гумера, специалист по продуктам в W.L. Гор и партнеры. Особое внимание к геометрии и размерам шприцев syriQ BioPure помогает обеспечить постоянную силу скольжения и продолжительность инъекции в течение всего срока годности продукта, а также сохранить целостность контейнера/укупорочного средства без использования силикона. Сверхнизкие остатки вольфрама и минимальные остатки клея канюли дополнительно снижают извлекаемость профиля и риск взаимодействия контейнера с лекарством (3).
До появления дизайна без силикона «фармацевтические производители, стремящиеся избежать вызванной силиконом агрегации и невидимых частиц, должны были выбирать флаконы, даже если они хотели предложить другие варианты доставки», — сказала Кристиан Гумера, специалист по продуктам в W.L. Гор и партнеры. Особое внимание к геометрии и размерам шприцев syriQ BioPure помогает обеспечить постоянную силу скольжения и продолжительность инъекции в течение всего срока годности продукта, а также сохранить целостность контейнера/укупорочного средства без использования силикона. Сверхнизкие остатки вольфрама и минимальные остатки клея канюли дополнительно снижают извлекаемость профиля и риск взаимодействия контейнера с лекарством (3).
Для предотвращения потенциально опасных случайных уколов иглой и соблюдения правил, действующих в различных частях земного шара, некоторые шприцы, такие как InnoSafe от Gerresheimer, содержат предварительно установленное пассивное защитное устройство. Благодаря предварительно установленному устройству нет необходимости в оборудовании для сборки после заполнения или в том, чтобы медицинские работники устанавливали защитный кожух перед введением инъекции. Преимущества включают улучшенную совместимость с автоматическими инъекторами и полностью скрытую иглу, что дает пациентам с фобией игл больше опыта. Конструкция также предотвращает случайное повторное использование и работает на существующих линиях розлива/финиша без какого-либо дополнительного оборудования или технологических операций.
Преимущества включают улучшенную совместимость с автоматическими инъекторами и полностью скрытую иглу, что дает пациентам с фобией игл больше опыта. Конструкция также предотвращает случайное повторное использование и работает на существующих линиях розлива/финиша без какого-либо дополнительного оборудования или технологических операций.
Наконец, COVID-19 стимулировал разработку предварительно заполненных шприцев, особенно в отношении хранения при низких температурах. Брандес прогнозирует: «Сейчас все вакцины против COVID-19 находятся во флаконах, но в ближайшие два-четыре года мы увидим новый тип шприца, который выдерживает -80 ºC».
Инновации в линии розлива/финишной обработки
Инновации в линии розлива/финишной обработки сосредоточены на автоматизации и гибкости для повышения производительности, повышения эффективности и более быстрой окупаемости инвестиций. По мере того, как размеры партий уменьшаются, требования к гибкости растут. Брандес объясняет: «Гибкость позволяет наполнить партию из 10 000 единиц во флаконах, а затем переключиться на другой формат упаковки и другой препарат на той же линии. Нет необходимости инвестировать в отдельные линии для флаконов, картриджей и шприцев».
Нет необходимости инвестировать в отдельные линии для флаконов, картриджей и шприцев».
Движущие силы автоматизации включают согласованность, нормативные требования и требования к рабочей силе. «Автоматизация значительно повышает согласованность и снижает вероятность человеческой ошибки, а также может предоставить возможности для расширенных возможностей проверки, в том числе тех, которые учитывают визуальные атрибуты, вес и объем заполнения», — говорит Дебора Смук, вице-президент по маркетингу и развитию бизнеса в Упаковочные машины TurboFil. Она отмечает: «Предпочтения FDA являются еще одним соображением. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) предпочитает меньше — в идеале вообще не касаться — компонентов шприца для асептического наполнения/обработки. Наконец, автоматизация снижает потребность в рабочей силе, уменьшает трудности работы в чистом помещении с полным набором средств индивидуальной защиты и снижает вероятность травм от повторяющихся движений».
Расширение компании Baxter Biopharma Solutions в Блумингтоне, штат Индиана, стоимостью 50 миллионов долларов США повысит эффективность и качество продукции за счет установки высокоскоростной автоматизированной линии наполнения шприцев, способной обрабатывать до 600 единиц/мин, и других усовершенствований (4 ). На новейшей линии розлива была установлена полностью автоматизированная система распаковки шприцев RTF, а автоматическая инспекционная машина заменила старую систему. «Линии [вторичной] упаковки также предлагают новые варианты упаковки, которые не содержат пластика, а также обладают защитой от вскрытия», — сообщает Венди Саффелл-Клеммер, ведущий научный сотрудник и старший директор Baxter. Кроме того, по ее словам, «доступна как одномерная, так и двухмерная онлайн-печать штрих-кодов. Наконец, системы информационных технологий, поддерживающие сериализацию, могут связываться с системой клиента, чтобы гарантировать, что применяемые серийные номера являются уникальными и отслеживаемыми в сети производственных площадок, которые может использовать клиент».
Новые системы были тщательно оценены с особым вниманием к предыдущему опыту работы с производителем приборов, ожидаемым требованиям клиентов и доступной площади для установки. «Новые технологии автоматизации были выбраны для повышения эффективности и качества продукции, — говорит Саффелл-Клеммер. «Например, — сообщает она, — недавно установленная инспекционная машина оснащена новейшими системами технического зрения, которые могут снизить уровень ложных срабатываний, а также предложить решение для обнаружения частиц в продуктах с тяжелой суспензией, таких как вакцины».
Civica Rx строит новое предприятие на 120 000 футов 2 в Петербурге, штат Вирджиния, в рамках производственного партнерства с Phlow Corporation, AMPAC Fine Chemicals и Институтом лекарственных средств для всех Университета Содружества Вирджинии. Завод в Петербурге будет запущен с одной линией розлива шприцев и одной линией розлива во флаконы, а также останется место для другой линии флаконов или шприцев. Линия шприцев рассчитана на производительность до 50 миллионов единиц в год. Оснащенные изолятором автоматические дозаторы с автоматическим визуальным контролем спроектированы так, чтобы свести к минимуму ручное вмешательство и максимально повысить уровень качества, соответствия и гарантии. Автоматизация «позволяет мыть и наполнять продукт с жесткими допусками без участия человека», — сообщает Стэн Бенсон, вице-президент и генеральный менеджер Civica Petersburg.
Линия шприцев рассчитана на производительность до 50 миллионов единиц в год. Оснащенные изолятором автоматические дозаторы с автоматическим визуальным контролем спроектированы так, чтобы свести к минимуму ручное вмешательство и максимально повысить уровень качества, соответствия и гарантии. Автоматизация «позволяет мыть и наполнять продукт с жесткими допусками без участия человека», — сообщает Стэн Бенсон, вице-президент и генеральный менеджер Civica Petersburg.
Контроль в процессе и взвешивание каждого шприца до и после наполнения обеспечивают точный объем наполнения. Автоматическая микрорегулировка поддерживает точность заполнения на протяжении всей партии. Вакуумная укупорка сводит к минимуму уровень кислорода в свободном пространстве (т. е. на расстоянии между продуктом и плунжером). Низкий уровень кислорода и небольшое свободное пространство повышают стабильность продукта и защищают эффективность продукта.
Все поверхности, соприкасающиеся с продуктом — от емкости для смешивания до игл для наполнения — предназначены для одноразового использования и поставляются стерилизованными гамма-излучением и готовыми к использованию. «Одноразовые системы устраняют необходимость в процессах очистки на месте и стерилизации, требующих тестирования и энергии [ресурсов]», — объясняет Бенсон. Каждый шприц будет подвергаться автоматизированному визуальному осмотру для подтверждения целостности контейнера и крышки и объема заполнения, а также проверки контейнера на наличие дефектов и твердых частиц. Испытание на утечку под высоким напряжением поможет проверить износ стекла.
«Одноразовые системы устраняют необходимость в процессах очистки на месте и стерилизации, требующих тестирования и энергии [ресурсов]», — объясняет Бенсон. Каждый шприц будет подвергаться автоматизированному визуальному осмотру для подтверждения целостности контейнера и крышки и объема заполнения, а также проверки контейнера на наличие дефектов и твердых частиц. Испытание на утечку под высоким напряжением поможет проверить износ стекла.
Что касается оборудования, компания TurboFil Packaging Machines предлагает несколько вариантов наполнения шприцев, включая моноблоки с поворотным делителем, наполнители с шагающими балками и роботизированную сборку деталей. «Форматы шприцев более разнообразны, чем флаконы, и требуют более гибкого подхода для решения сложных проблем наполнения, связанных с вязкостью продукта, удалением воздуха, утечкой и, конечно же, точностью», — объясняет Смук.
Система наполнения и сборки шприцев SimpliFil от TurboFil, использующая универсальную, но точную установку, которая точно наполняет шприцы с помощью керамического поршня, перистальтического насоса или непосредственно из мешка-резервуара, работает с малыми и средними партиями. Конфигурация поворотной балки обеспечивает интуитивно понятное управление и упрощенное переключение на основе рецепта. Для повышения точности технология TipFil позволяет наполнять шприцы всех типов через наконечник — инновация, позволяющая экономить время и устраняющая необходимость вставлять поршни после заполнения.
Конфигурация поворотной балки обеспечивает интуитивно понятное управление и упрощенное переключение на основе рецепта. Для повышения точности технология TipFil позволяет наполнять шприцы всех типов через наконечник — инновация, позволяющая экономить время и устраняющая необходимость вставлять поршни после заполнения.
Предлагая полный контроль параметров наполнения в одинарном или сдвоенном режиме, настольный шприц-наполнитель TipFil точно и последовательно наполняет до 12 единиц/мин. Поршневой механизм с сервоприводом втягивает иглу назад через поршень, при этом расстояние, на которое перемещается поршень, определяет количество введенного лекарства. Помимо прочих преимуществ, этот метод избавляет от необходимости чистить посторонний прибор учета. Ключевым свойством системы является ее универсальность. Устройство может выполнять наполнение через наконечник для жидкостей или вязких продуктов для типичных сценариев подачи, включая бункеры и резервуары. Дополнительное приспособление позволяет наполнять бутылки или флаконы. Контроль обратного всасывания повышает точность заполнения, а все детали, контактирующие с продуктом, полностью одноразовые.
Контроль обратного всасывания повышает точность заполнения, а все детали, контактирующие с продуктом, полностью одноразовые.
Ссылки
1. Emergen Research, «Доля рынка предварительно наполненных шприцев быстро растет с учетом последних тенденций и перспектив на 2020–2027 годы», пресс-релиз, 5 апреля 2021 г.
2. Stevanato Group, «Stevaato Group подписывает соглашение с Gerresheimer представить интегрированное системное решение Twist-off, ITC, для шприцев Gx RTF», пресс-релиз, 6 октября 2020 г.,
3. Pharm.Tech., «Система стеклянных шприцев снижает силу инъекции без использования силикона», PharmTech .com, 21 ноября 2019 г.
4. Baxter International Inc., «Baxter BioPharma Solutions объявляет об инвестициях в размере 50 миллионов долларов США в расширение производства стерильных наполнителей и отделочных материалов в Блумингтоне, штат Индиана», пресс-релиз, 24 ноября 2020 г.
Об авторе
Халли Форчинио является редактором упаковки BioPharm International .
Детали статьи
BioPharm International
Vol. 34, № 6
июнь 2021 г.
Страницы: 32–35
Цитирование
При ссылке на эту статью указывайте ее как H. Forcinio, «Инновации удовлетворяют растущий спрос на предварительно заполненные шприцы», BioPharm International 34 (6) 2021.
Выпуск для скачивания: BioPharm International-06-01-2021
Связанный контент:
Производство, наполнение/отделкаПроизводствоУпаковка, маркировка и системы распределенияПроизводство парентеральных и инъекционных препаратовBioPharm International-06-01-2021
Связанная статья >>>
| ФОКУС: ЗЕЛЕНАЯ УЛИЦА К ИННОВАЦИЯМ Магомедов Г.
Молчанова Е.Н., Шипарева М.Г., Кубаева М.Б., Кочиева Д.Р. Использование нутовой муки в производстве воздушных полуфабрикатов
Талейсник М.А., Солдатова Е.А., Щербакова Н.А., Герасимов Т.В., Савенкова Т.В. Совершенствование технологии производства сахарного печенья с использованием подвесной системы
Бутин С.А., Лубенина И.А., Скобельская З.Г. Оптимизация рецептур жевательных мармеладов, содержащих различные антикристаллизаторы
СЫРЬЕ И ДОБАВКИ Савченкова Е.П. Знакомый с детства Вкус от ГК ПТИ! Задорожный Е. Российский рынок желатина: тенденции и перспективы КОНТРОЛЬ И КАЧЕСТВО Ткешелашвили М.
ПРОИЗВОДСТВЕННЫЕ ТЕХНОЛОГИИ Крылова Е.Н., Маврина Е.Н., Савенкова Т.В. Новое в технологии производства помадных конфет
|



 О., Лобосова Л.А., Магомедов М.Г., Магомедова А.З., Решетнева А.С., Топорова И.Х., Арсанукаев И.Х. Желейный мармелад с мягким сливочным сыром
О., Лобосова Л.А., Магомедов М.Г., Магомедова А.З., Решетнева А.С., Топорова И.Х., Арсанукаев И.Х. Желейный мармелад с мягким сливочным сыром

 ,
Этот адрес электронной почты защищен от спам-ботов. У вас должен быть включен JavaScript для просмотра.
,
Этот адрес электронной почты защищен от спам-ботов. У вас должен быть включен JavaScript для просмотра.  Целью исследования является разработка технологии меренге, содержащей муку из нута, с высокими органолептическими показателями. Научно-исследовательская работа проводилась в Московском государственном университете пищевых производств. Создана технология меренге из нутовой муки, прошедшей предварительную термическую обработку. Пробы муки анализировали через 4, 7, 10, 13, 15, 18, 20, 23, 25 минут нагревания до 150 °С. Установлено, что запах сырых бобов в муке уменьшается с увеличением термической обработки и постепенно появляется запах орехов. Показано влияние продолжительности термической обработки нутовой муки на органолептические качества безе из нута. По органолептической оценке лучшим является образец, содержащий 20 % муки из нута, прогретый в течение 15 мин при 150 °С.была сделана балльная гедонистическая шкала. Разработанный образец получил среднюю оценку 7,4 балла по всем показателям, что означает относительно высокий уровень желанности среди потребителей. Изменение рецептуры позволило обогатить безе белком более чем в 2 раза и пищевыми волокнами до 1,6%.
Целью исследования является разработка технологии меренге, содержащей муку из нута, с высокими органолептическими показателями. Научно-исследовательская работа проводилась в Московском государственном университете пищевых производств. Создана технология меренге из нутовой муки, прошедшей предварительную термическую обработку. Пробы муки анализировали через 4, 7, 10, 13, 15, 18, 20, 23, 25 минут нагревания до 150 °С. Установлено, что запах сырых бобов в муке уменьшается с увеличением термической обработки и постепенно появляется запах орехов. Показано влияние продолжительности термической обработки нутовой муки на органолептические качества безе из нута. По органолептической оценке лучшим является образец, содержащий 20 % муки из нута, прогретый в течение 15 мин при 150 °С.была сделана балльная гедонистическая шкала. Разработанный образец получил среднюю оценку 7,4 балла по всем показателям, что означает относительно высокий уровень желанности среди потребителей. Изменение рецептуры позволило обогатить безе белком более чем в 2 раза и пищевыми волокнами до 1,6%.
 14-17
14-17 Разработаны современные технологические приемы производства сахарного печенья: добавление морковного пюре на стадии приготовления суспензии, смеси полуфабрикатов и сыпучих компонентов, кроме муки и крахмала; обработка суспензии в условиях сочетания гидродинамической и акустической кавитации на лабораторной кавитационной установке «Сиринкс 250К» в течение 45 минут. В результате уменьшается размер частиц твердой фазы со 180 мкм до 40 мкм и вязкость суспензии на 33%. Согласно основным принципам физико-химической механики максимальное рассеивание частиц в твердой фазе, а также увеличение их концентрации в единице объема и, как следствие, уменьшение расстояния между частицами твердой фазы и возможность увеличения числа точечных контактов, по нашему мнению, приводит к глубокому изменению структуры высококонцентрированной суспензии и создаются условия для снижения адгезивных свойств теста. В созданной инновационной технологии производства сахарного печенья стало возможным использовать около 9% морковного пюре, что позволяет снизить рецептурное количество сахара на 20 %.
Разработаны современные технологические приемы производства сахарного печенья: добавление морковного пюре на стадии приготовления суспензии, смеси полуфабрикатов и сыпучих компонентов, кроме муки и крахмала; обработка суспензии в условиях сочетания гидродинамической и акустической кавитации на лабораторной кавитационной установке «Сиринкс 250К» в течение 45 минут. В результате уменьшается размер частиц твердой фазы со 180 мкм до 40 мкм и вязкость суспензии на 33%. Согласно основным принципам физико-химической механики максимальное рассеивание частиц в твердой фазе, а также увеличение их концентрации в единице объема и, как следствие, уменьшение расстояния между частицами твердой фазы и возможность увеличения числа точечных контактов, по нашему мнению, приводит к глубокому изменению структуры высококонцентрированной суспензии и создаются условия для снижения адгезивных свойств теста. В созданной инновационной технологии производства сахарного печенья стало возможным использовать около 9% морковного пюре, что позволяет снизить рецептурное количество сахара на 20 %. Это снижает плотность печенья и одновременно увеличивает пропитываемость и повышает потребительскую ценность.
Это снижает плотность печенья и одновременно увеличивает пропитываемость и повышает потребительскую ценность. 
 Установлено соотношение основных рецептурных компонентов мармеладных цукатов: сахарный песок, антикристаллизатор (патока, инвертный сироп, патока), желирующий агент (желатин), натуральный ароматизатор (фруктовый сок). В исследовании использовался метод планирования полного факторного эксперимента. Диапазоны изменения факторов в матрице планирования составляют: соотношение доли патоки и доли сахара-песка от 0,67 до 2,33 долей ед.; доля желатина от 5 до 8%; доля фруктового сока от 2 до 6% (значения даны в процентах от рецептуры на сухие вещества). Полученные мармеладные мармелад оценивали по двум показателям: органолептический балл, балл; реологические свойства (общая, упругая, пластическая деформация, мм, отношение упругой деформации к пластической). Определены аналитические зависимости органолептической оценки и отношения упругой деформации к пластической деформации от доли компонентов рецептуры, на основании которых с использованием программного обеспечения MatLab установлены оптимальные рецептурные количества основных компонентов мармелада.
Установлено соотношение основных рецептурных компонентов мармеладных цукатов: сахарный песок, антикристаллизатор (патока, инвертный сироп, патока), желирующий агент (желатин), натуральный ароматизатор (фруктовый сок). В исследовании использовался метод планирования полного факторного эксперимента. Диапазоны изменения факторов в матрице планирования составляют: соотношение доли патоки и доли сахара-песка от 0,67 до 2,33 долей ед.; доля желатина от 5 до 8%; доля фруктового сока от 2 до 6% (значения даны в процентах от рецептуры на сухие вещества). Полученные мармеладные мармелад оценивали по двум показателям: органолептический балл, балл; реологические свойства (общая, упругая, пластическая деформация, мм, отношение упругой деформации к пластической). Определены аналитические зависимости органолептической оценки и отношения упругой деформации к пластической деформации от доли компонентов рецептуры, на основании которых с использованием программного обеспечения MatLab установлены оптимальные рецептурные количества основных компонентов мармелада. упаковка. Результаты работы представляют интерес для специалистов кондитерской отрасли. Их можно использовать для расширения ассортимента продукции в результате создания фирменных рецептур.
упаковка. Результаты работы представляют интерес для специалистов кондитерской отрасли. Их можно использовать для расширения ассортимента продукции в результате создания фирменных рецептур.  Е., Бобожонова Г.А., Кошелева И.П. Шоколад и шоколадная глазурь, устойчивая к поседению
Е., Бобожонова Г.А., Кошелева И.П. Шоколад и шоколадная глазурь, устойчивая к поседению Плеханова. Для исследования были изготовлены образцы шоколада и глазури на основе какао-масла, в рецептуру которых добавлена добавка, включающая молочный жир/изомальт/полидекстрозу. Контрольными образцами были темный шоколад и глазурь, приготовленные по единой рецептуре. Для формирования поседения образцы подвергались воздействию колебаний температуры и относительной влажности. Измерение цвета шоколада осуществляется инструментальным методом, основанным на анализе оптических характеристик продукта. Коэффициенты спектров отражения образцов шоколада были переведены в цветовые координаты пространства CIEL*a*b* 1976. Диагностировано появление налета шоколада по изменению параметра светлоты L* (CIEL*a*b*). Определено влияние введения добавки, включающей молочный жир/изомальт/полидекстрозу, на жировое и сахарное поседение в рецептуре шоколадных масс. На основе исследований разработан состав шоколадной массы, практически не изменяющий вкус готовых шоколадных изделий со значительно сниженным содержанием сахара в составе, выдерживающий хранение при температуре от 0 до 25 °С и относительной влажности 85 % без внешние признаки цветения.
Плеханова. Для исследования были изготовлены образцы шоколада и глазури на основе какао-масла, в рецептуру которых добавлена добавка, включающая молочный жир/изомальт/полидекстрозу. Контрольными образцами были темный шоколад и глазурь, приготовленные по единой рецептуре. Для формирования поседения образцы подвергались воздействию колебаний температуры и относительной влажности. Измерение цвета шоколада осуществляется инструментальным методом, основанным на анализе оптических характеристик продукта. Коэффициенты спектров отражения образцов шоколада были переведены в цветовые координаты пространства CIEL*a*b* 1976. Диагностировано появление налета шоколада по изменению параметра светлоты L* (CIEL*a*b*). Определено влияние введения добавки, включающей молочный жир/изомальт/полидекстрозу, на жировое и сахарное поседение в рецептуре шоколадных масс. На основе исследований разработан состав шоколадной массы, практически не изменяющий вкус готовых шоколадных изделий со значительно сниженным содержанием сахара в составе, выдерживающий хранение при температуре от 0 до 25 °С и относительной влажности 85 % без внешние признаки цветения.
 Кондитерские изделия нового поколения займут значительное место среди продуктов, оказывающих положительное влияние на организм человека, так как уменьшают количество углеводов, снижают калорийность продуктов, отсутствие сахарозы. Исследования, проводимые во Всероссийском научно-исследовательском институте кондитерской промышленности (г. Москва), направлены на создание современных видов кондитерских изделий без сахара, на подсластителях. В качестве подсластителя использовали полиол изомальт с чистым сладким вкусом, низкой калорийностью (~ 2 ккал) и низким гликемическим индексом. В этом заключается основное преимущество использования изомальта для производства кондитерских изделий в профилактических целях. При замене изомальта на сахарозу в рецептуре помадных конфет установлено соотношение компонентов, оптимальные физико-химические показатели помадной патоки: влажность, вязкость, количество редуцирующих веществ, в основном влияющих на процесс кристаллизации. При замене изомальта в рецептуре на сахарозу редуцирующие вещества образуются только за счет патоки.
Кондитерские изделия нового поколения займут значительное место среди продуктов, оказывающих положительное влияние на организм человека, так как уменьшают количество углеводов, снижают калорийность продуктов, отсутствие сахарозы. Исследования, проводимые во Всероссийском научно-исследовательском институте кондитерской промышленности (г. Москва), направлены на создание современных видов кондитерских изделий без сахара, на подсластителях. В качестве подсластителя использовали полиол изомальт с чистым сладким вкусом, низкой калорийностью (~ 2 ккал) и низким гликемическим индексом. В этом заключается основное преимущество использования изомальта для производства кондитерских изделий в профилактических целях. При замене изомальта на сахарозу в рецептуре помадных конфет установлено соотношение компонентов, оптимальные физико-химические показатели помадной патоки: влажность, вязкость, количество редуцирующих веществ, в основном влияющих на процесс кристаллизации. При замене изомальта в рецептуре на сахарозу редуцирующие вещества образуются только за счет патоки. Кроме того, его количество также влияет на вязкость сиропа. Исследования показали, что оптимальным является добавление 20 % мелассы к массе изомальта. Количество редуцирующих веществ в сиропе ~ 6,2%. Исследования процесса кристаллизации помадного сиропа на изомальте показали, что изомальт кристаллизуется в виде мелких кристаллов (0,51) мкм и получается монолитная сцементированная масса. Для роста кристаллов изомальта необходимо добавлять кристаллический изомальт при расплавлении помадного сиропа. Полученная помадная масса имела в целом размер кристаллов 1012 мкм и хорошие вкусовые качества. Влажность помады является одной из важных характеристик, определяющих ее консистенцию, которая в свою очередь зависит от вязкости и пластической прочности. Исследованиями установлено, что при влажности помадного сиропа ~12 % процесс кристаллизации протекает нормально, вязкость массы составляет ~30 Па·с. Помадка получается однородной консистенции и мягкой структуры. Существенным недостатком помадных конфет является то, что при хранении они черствеют (высыхают), теряют влагу.
Кроме того, его количество также влияет на вязкость сиропа. Исследования показали, что оптимальным является добавление 20 % мелассы к массе изомальта. Количество редуцирующих веществ в сиропе ~ 6,2%. Исследования процесса кристаллизации помадного сиропа на изомальте показали, что изомальт кристаллизуется в виде мелких кристаллов (0,51) мкм и получается монолитная сцементированная масса. Для роста кристаллов изомальта необходимо добавлять кристаллический изомальт при расплавлении помадного сиропа. Полученная помадная масса имела в целом размер кристаллов 1012 мкм и хорошие вкусовые качества. Влажность помады является одной из важных характеристик, определяющих ее консистенцию, которая в свою очередь зависит от вязкости и пластической прочности. Исследованиями установлено, что при влажности помадного сиропа ~12 % процесс кристаллизации протекает нормально, вязкость массы составляет ~30 Па·с. Помадка получается однородной консистенции и мягкой структуры. Существенным недостатком помадных конфет является то, что при хранении они черствеют (высыхают), теряют влагу. Для продления срока хранения помадных конфет в рецептуру необходимо ввести влагоудерживающую добавку. В исследованиях использовали полиолсорбит, так как он обладает высокой гигроскопичностью и способностью удерживать влагу. Исследования показали, что при введении 5 % сорбита потеря влаги в продуктах за 1,5 месяца хранения составила ~ 17 %, а продукты сохранили удовлетворительные вкусовые качества. Температура кипения сиропа влияет на влажность помадных конфет и, следовательно, на время структурообразования и пластическую прочность помадных конфет. В ходе исследований установлено, что помаду на изомальте с сорбитом можно производить с большей влажностью. При этом сокращается процесс структурообразования, помадка обладает хорошими вкусовыми качествами. Это связано с тем, что сорбит связывает влагу в продукте и ускоряется процесс структурирования. Исследования показали, что помадные конфеты можно делать без сахара. Полученные продукты можно отнести к профилактическим продуктам, так как количество углеводов снижено на 70%, калорийность на 160 ккал.
Для продления срока хранения помадных конфет в рецептуру необходимо ввести влагоудерживающую добавку. В исследованиях использовали полиолсорбит, так как он обладает высокой гигроскопичностью и способностью удерживать влагу. Исследования показали, что при введении 5 % сорбита потеря влаги в продуктах за 1,5 месяца хранения составила ~ 17 %, а продукты сохранили удовлетворительные вкусовые качества. Температура кипения сиропа влияет на влажность помадных конфет и, следовательно, на время структурообразования и пластическую прочность помадных конфет. В ходе исследований установлено, что помаду на изомальте с сорбитом можно производить с большей влажностью. При этом сокращается процесс структурообразования, помадка обладает хорошими вкусовыми качествами. Это связано с тем, что сорбит связывает влагу в продукте и ускоряется процесс структурирования. Исследования показали, что помадные конфеты можно делать без сахара. Полученные продукты можно отнести к профилактическим продуктам, так как количество углеводов снижено на 70%, калорийность на 160 ккал.