Приказы Росздравнадзора
[ Введите номер/дату/часть названия документа или произвольную фразу ]
| Приказ Росздравнадзора от 23.08.2022 N 7817 «Об утверждении Перечня должностей федеральной государственной гражданской службы в центральном аппарате Федеральной службы по надзору в сфере здравоохранения и ее территориальных органах, исполнение должностных обязанностей по которым связано с использованием сведений, составляющих государственную тайну, при назначении на которые конкурс может не проводиться» (Зарегистрировано в Минюсте России 16.09.2022 N 70131) |
| Письмо Росздравнадзора от 19.08.2022 N 02И-899/22 «О применении раздела VII постановления Правительства Российской Федерации N 593» |
| Письмо Росздравнадзора от 08.08.2022 N 04и-879/22 «Об изменениях в порядке ввоза медицинских изделий» |
Письмо Росздравнадзора от 25. 07.2022 N 01и-809/22 07.2022 N 01и-809/22«О соблюдении температурного режима» |
| Письмо Росздравнадзора от 22.04.2022 N 01и-431/22 «О внесение реестровых записей в ЕРУЛ» |
| Письмо Росздравнадзора от 08.04.2022 N 01и-376/22 «О рекомендациях по эксплуатации и техническому обслуживанию медицинских изделий» |
| Письмо Росздравнадзора от 28.03.2022 N 01и-323/22 «О предоставлении выписки из реестра лицензий» |
| Приказ Росздравнадзора от 25.03.2022 N 2182 «Об утверждении Программы профилактики рисков причинения вреда (ущерба) охраняемым законом ценностям при осуществлении федерального государственного (контроля (надзора) в сфере обращения биомедицинских клеточных продуктов в 2022 году» |
Приказ Росздравнадзора от 22. 03.2022 N 2075 03.2022 N 2075«Об утверждении Порядка выдачи разрешений на вывоз за пределы территории Российской Федерации отдельных видов товаров медицинского назначения по перечню согласно приложению N 6 к постановлению Правительства Российской Федерации от 9 марта 2022 г. N 312 «О введении на временной основе разрешительного порядка вывоза отдельных видов товаров за пределы территории Российской Федерации» (Зарегистрировано в Минюсте России 29.03.2022 N 67963) |
| Приказ Росздравнадзора от 10.03.2022 N 1745 «Об утверждении формы Акта возврата образцов лекарственных средств» (Зарегистрировано в Минюсте России 08.04.2022 N 68122) |
| Информация Росздравнадзора «О размещении электронной формы подачи сведений в соответствии с приказом Росздравнадзора от 25.11.2021 N 11020» |
Приказ Росздравнадзора от 02. 03.2022 N 1578 03.2022 N 1578«О внесении изменений в приложение к приказу Федеральной службы по надзору в сфере здравоохранения от 17 декабря 2021 г. N 12029 «Об утверждении Программы профилактики рисков причинения вреда (ущерба) охраняемым законом ценностям при осуществлении федерального государственного (контроля (надзора) в сфере обращения лекарственных средств для медицинского применения в 2022 году» |
| Предложения (практические рекомендации) по организации внутреннего контроля качества и безопасности медицинской деятельности в медицинской организации (стационаре). Вторая версия |
| Приказ Росздравнадзора от 25.02.2022 N 1411 «Об утверждении ведомственного плана Федеральной службы по надзору в сфере здравоохранения по реализации Концепции открытости федеральных органов исполнительной власти в 2022 году» |
Письмо Росздравнадзора от 22. 02.2022 N 03-9777/22 02.2022 N 03-9777/22«О допуске к медицинской и фармацевтической деятельности» |
| Приказ Росздравнадзора от 19.02.2022 N 1185 «Об утверждении форм проверочных листов (списков контрольных вопросов, ответы на которые свидетельствуют о соблюдении или несоблюдении контролируемым лицом обязательных требований), используемых Федеральной службой по надзору в сфере здравоохранения и ее территориальными органами при осуществлении федерального государственного контроля (надзора) в сфере обращения лекарственных средств» (Зарегистрировано в Минюсте России 25.02.2022 N 67499) |
Изменения, которые вносятся в Приложение к приказу Федеральной службы по надзору в сфере здравоохранения от 16 декабря 2021 г. N 11979 02.2022 N 1152) 02.2022 N 1152) |
| Приказ Росздравнадзора от 16.12.2021 N 11979 (ред. от 18.02.2022) «Об утверждении программы профилактики рисков причинения вреда (ущерба) охраняемым законом ценностям при осуществлении федерального государственного контроля (надзора) за обращением медицинских изделий в 2022 году» (вместе с «Программой профилактики рисков причинения вреда (ущерба) охраняемым законом ценностям при осуществлении федерального государственного контроля (надзора) за обращением медицинских изделий в 2022 году», утв. Общественным советом при Росздравнадзоре |
| Приказ Росздравнадзора от 17.02.2022 N 1143 «Об утверждении Плана Федеральной службы по надзору в сфере здравоохранения по противодействию коррупции на 2022 — 2024 годы» |
Приказ Росздравнадзора от 11.02.2022 N 973 02.2022 N 67487) 02.2022 N 67487) |
| Приказ Росздравнадзора от 10.02.2022 N 886 |
| Приказ Росздравнадзора от 09.02.2022 N 826 «Об утверждении форм документов, используемых Федеральной службой по надзору в сфере здравоохранения в процессе лицензирования деятельности по обороту наркотических средств, психотропных веществ и их прекурсоров, культивированию наркосодержащих растений» (Зарегистрировано в Минюсте России 28.02.2022 N 67533) |
Приказ Росздравнадзора от 09.02.2022 N 825 02.2022 N 67530) 02.2022 N 67530) |
| Приказ Росздравнадзора от 04.02.2022 N 756 «Об утверждении формы оценочного листа, в соответствии с которым Федеральной службой по надзору в сфере здравоохранения и ее территориальными органами проводится оценка соответствия соискателя лицензии или лицензиата лицензионным требованиям при осуществлении медицинской деятельности (за исключением указанной деятельности, осуществляемой медицинскими организациями и другими организациями, входящими в частную систему здравоохранения, на территории инновационного центра «Сколково»)» |
| Приказ Росздравнадзора от 02.02.2022 N 642 «Об утверждении форм документов, используемых Федеральной службой по надзору в сфере здравоохранения в процессе лицензирования деятельности по техническому обслуживанию медицинских изделий (за исключением случая, если техническое обслуживание осуществляется для обеспечения собственных нужд юридического лица или индивидуального предпринимателя, а также случая технического обслуживания медицинских изделий с низкой степенью потенциального риска их применения)» (Зарегистрировано в Минюсте России |
Приказ Росздравнадзора от 25. 01.2022 N 421 01.2022 N 421«Об утверждении порядка организации работы Росздравнадзора по обобщению правоприменительной практики контрольно-надзорной деятельности Росздравнадзора» |
| Приказ Росздравнадзора от 19.01.2022 N 184 «Об утверждении формы оценочного листа, в соответствии с которым Федеральной службой по надзору в сфере здравоохранения проводится оценка соответствия соискателя лицензии или лицензиата лицензионным требованиям при осуществлении деятельности по производству биомедицинских клеточных продуктов» (Зарегистрировано в Минюсте России 25.02.2022 N 67498) |
| Приказ Росздравнадзора от 19.01.2022 N 198 «Об утверждении формы заключения по результатам экспертизы качества, безопасности и эффективности незарегистрированного медицинского изделия для диагностики in vitro» (Зарегистрировано в Минюсте России 17.02.2022 N 67326) |
Приказ Росздравнадзора от 19. 01.2022 N 195 01.2022 N 195«Об утверждении форм оценочных листов, в соответствии с которыми Федеральной службой по надзору в сфере здравоохранения и ее территориальными органами проводится оценка соответствия соискателя лицензии или лицензиата лицензионным требованиям при осуществлении фармацевтической деятельности» (Зарегистрировано в Минюсте России 24.02.2022 N 67449) |
| Приказ Росздравнадзора от 10.01.2022 N 1 «Об утверждении форм проверочных листов (списков контрольных вопросов, ответы на которые свидетельствуют о соблюдении или несоблюдении контролируемым лицом обязательных требований), используемых Федеральной службой по надзору в сфере здравоохранения и ее территориальными органами при осуществлении федерального государственного контроля (надзора) за обращением медицинских изделий» (Зарегистрировано в Минюсте России 22.02.2022 N 67423) |
Приказ Росздравнадзора от 30.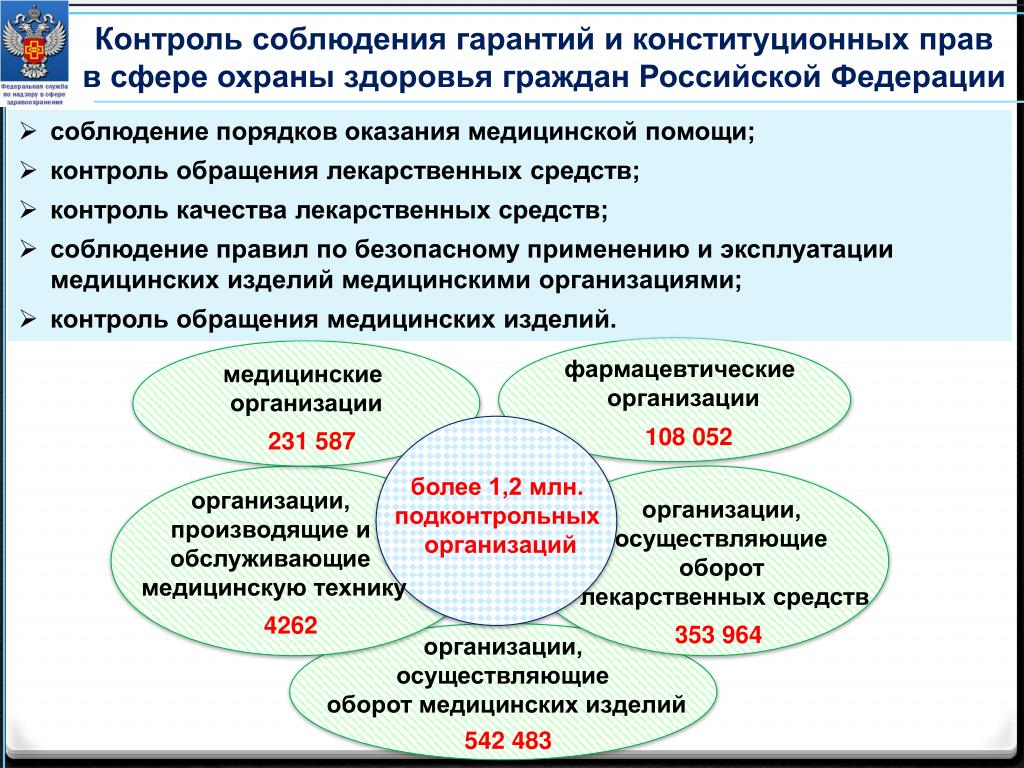 12.2021 N 12536 12.2021 N 12536«Об утверждении формы оценочного листа, в соответствии с которым Федеральной службой по надзору в сфере здравоохранения и ее территориальными органами проводится оценка соответствия соискателя лицензии или лицензиата лицензионным требованиям при осуществлении деятельности по техническому обслуживанию медицинских изделий (за исключением случая, если техническое обслуживание осуществляется для обеспечения собственных нужд юридического лица или индивидуального предпринимателя, а также случая |
| Приказ Росздравнадзора от 29.12.2021 N 12462 «Об утверждении форм документов, используемых Федеральной службой по надзору в сфере здравоохранения в процессе лицензирования медицинской деятельности (за исключением указанной деятельности, осуществляемой медицинскими организациями и другими организациями, входящими в частную систему здравоохранения, на территории инновационного центра «Сколково»)» (Зарегистрировано в Минюсте России 02. |
| Приказ Росздравнадзора от 23.12.2021 N 12197 «Об утверждении формы проверочного листа (списка контрольных вопросов, ответы на которые свидетельствуют о соблюдении или несоблюдении контролируемым лицом обязательных требований), используемого Федеральной службой по надзору в сфере здравоохранения и ее территориальными органами при осуществлении федерального государственного контроля (надзора) в сфере обращения биомедицинских клеточных продуктов» (Зарегистрировано в Минюсте России 22.02.2022 N 67422) |
| Приказ Росздравнадзора от 22.12.2021 N 12133 «Об утверждении Порядка составления и утверждения плана финансово-хозяйственной деятельности федеральных государственных бюджетных учреждений, находящихся в ведении Федеральной службы по надзору в сфере здравоохранения» (Зарегистрировано в Минюсте России 31.01.2022 N 67066) |
Приказ Росздравнадзора от 17. 12.2021 N 12029 12.2021 N 12029«Об утверждении Программы профилактики рисков причинения вреда (ущерба) охраняемым законом ценностям при осуществлении федерального государственного (контроля (надзора) в сфере обращения лекарственных средств для медицинского применения в 2022 году» |
| Письмо Росздравнадзора от 02.12.2021 N 09-14-57843 «О рассмотрении обращения» |
| Приказ Росздравнадзора от 29.11.2021 N 11111 «Об утверждении Административного регламента Федеральной службы по надзору в сфере здравоохранения по предоставлению государственной услуги по выдаче разрешения для ввоза на территорию Российской Федерации медицинского изделия для оказания медицинской помощи по жизненным показаниям конкретного пациента» (Зарегистрировано в Минюсте России 30.11.2021 N 66159) |
Приказ Росздравнадзора от 25.11. 2021 N 11020 2021 N 11020«Об утверждении Порядка представления производителем (изготовителем) медицинского изделия (его уполномоченным представителем) или лицом, осуществляющим ввоз на территорию Российской Федерации медицинских изделий, сведений в уполномоченный федеральный орган исполнительной власти, осуществляющий функции по контролю и надзору в сфере охраны здоровья» (Зарегистрировано в Минюсте России 26.11.2021 N 66022) |
| Приказ Росздравнадзора от 25.11.2021 N 10958 «Об аттестации экспертов, привлекаемых Федеральной службой по надзору в сфере здравоохранения (территориальными органами Федеральной службы по надзору в сфере здравоохранения) к осуществлению экспертизы в целях федерального государственного контроля (надзора)» (вместе с «Правилами формирования и ведения реестра экспертов, привлекаемых Федеральной службой по надзору в сфере здравоохранения (территориальным органом Федеральной службы по надзору в сфере здравоохранения) к осуществлению экспертизы |
Апелляционное определение Апелляционной коллегии Верховного Суда РФ от 11. 11.2021 N АПЛ21-418 11.2021 N АПЛ21-418«Об оставлении без изменения решения Решения Верховного Суда РФ от 16.08.2021 N АКПИ21-444, которым было отказано в удовлетворении заявления о признании недействующим письма Росздравнадзора от 05.02.2016 N 09-С-571-1414» |
| Письмо Росздравнадзора от 01.11.2021 N 01-62909/21 «О выявлении граждан, принимающих активное участие в антипрививочной кампании» |
| Приказ Росздравнадзора от 28.10.2021 N 10330 «Об утверждении Административного регламента Федеральной службы по надзору в сфере здравоохранения по предоставлению государственной услуги по выдаче заключения (разрешительного документа) для получения лицензии на право ввоза в Российскую Федерацию и вывоза из Российской Федерации органов и тканей человека, крови и ее компонентов (за исключением образцов биологических материалов человека, гемопоэтических стволовых клеток, костного мозга, донорских лимфоцитов в целях проведения неродственной |
Приказ Росздравнадзора от 22. 10.2021 N 10084 10.2021 N 10084«Об утверждении Порядка сдачи специального экзамена лицами, получившими медицинское или фармацевтическое образование в иностранных государствах» (Зарегистрировано в Минюсте России 26.10.2021 N 65575) |
| Приказ Росздравнадзора от 15.09.2021 N 8674 «Об утверждении Плана Федеральной службы по надзору в сфере здравоохранения по противодействию коррупции на 2021 — 2024 годы» |
| Приказ Росздравнадзора от 20.08.2021 N 7880 «Об утверждении формы протокола отбора медицинских изделий при проведении федерального государственного контроля (надзора) за обращением медицинских изделий» (Зарегистрировано в Минюсте России 21.09.2021 N 65067) |
| Решение Верховного Суда РФ от 16.08.2021 N АКПИ21-444 «Об отказе в удовлетворении заявления об оспаривании письма Росздравнадзора от 05. |
| Письмо Росздравнадзора от 12.08.2021 N 02И-1024/21 «О проведении эксперимента по лицензированию фармацевтической деятельности» |
| Письмо Росздравнадзора от 13.07.2021 N 10-38863/21 «О предоставлении информации» |
| Письмо Росздравнадзора от 23.06.2021 N 02и-802/21 «О правилах розничной продажи лекарственных препаратов дистанционным способом» |
| Приказ Росздравнадзора от 20.05.2021 N 4513 «Об утверждении классификации неблагоприятных событий, связанных с обращением медицинских изделий» (Зарегистрировано в Минюсте России 10.06.2021 N 63826) |
Страница 1 из 16.
следующая >
Задайте вопрос юристу:
+7 (499) 703-46-71 — для жителей Москвы и Московской области
+7 (812) 309-95-68 — для жителей Санкт-Петербурга и Ленинградской области
Органы власти, осуществляющие надзор — медицинский центр в Москве
В соответствии с Законом РФ О защите прав потребителей предоставляет информацию о надзорных органах, осуществляющих свою деятельность в области медицинского обслуживания.
Департамент здравоохранения г. Москвы
Адрес:127006, г. Москва, Оружейный переулок, д.43
Режим работы:
Пн. – Чт. – с 08.00 до 17.00
Пт. – с 08.00 до 15.45
Обед — с 12.30 до 13.30
Сб., Вс. – Выходной
Тел. 8(499)25 – 83– 00
Адрес: г. Москва, 2 Щелковский переулок, д. 4 «А», стр.4
Режим работы:
Пн. – Чт. – с 09.00 до 18.00
Пт. – с 09.00 до 16.45
Обед — с 13.30 до 14.30
Сб., Вс. – Выходной
Федеральная служба по надзору в сфере здравоохранения
Федеральная служба по надзору в сфере здравоохранения (далее — Росздравнадзор) образована в соответствии с Указом Президента Российской Федерации от 9 марта 2004 г. № 314 «О системе и структуре федеральных органов исполнительной власти» и является федеральным органом исполнительной власти, осуществляющим функции по контролю и надзору в сфере здравоохранения.
Росздравнадзор находится в подведомственности Министерства здравоохранения Российской Федерации и руководствуется в своей деятельности Конституцией Российской Федерации, федеральными конституционными законами, федеральными законами, актами Президента Российской Федерации и Правительства Российской Федерации, международными договорами Российской Федерации, актами Министерства здравоохранения Российской Федерации, а также Положением «О Федеральной службе по надзору в сфере здравоохранения», утвержденным постановлением Правительства Российской Федерации от 30.06.2004 № 323.
Территориальный орган Росздравнадзора по г. Москве и Московской области.
Обращение граждан в ТО Росздравнадзора по г. Москве и Московской области.
Адрес: г. Москва, ул. Вучетича, д.12А
Телефон для записи на прием: +7 (495) 611-55-77
Руководитель территориального органа: Плотницкий Андрей Николаевич
В обращении гражданин в обязательном порядке указывает свои фамилию, имя, отчество (последнее – при наличии), почтовый адрес, если ответ должен быть направлен в письменной форме и адрес электронной почты, если ответ должен быть направлен в форме электронного документа.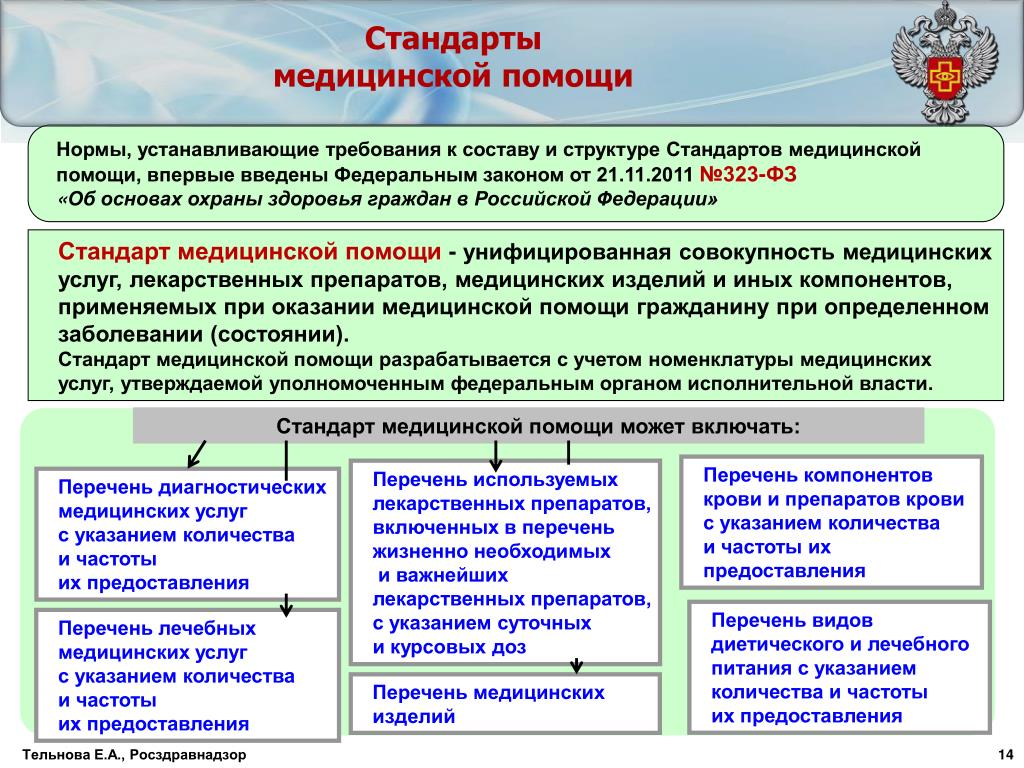 Гражданин вправе приложить к обращению необходимые документы и материалы в электронной форме, либо направить указанные документы и материалы или их копии в письменной форме.
Гражданин вправе приложить к обращению необходимые документы и материалы в электронной форме, либо направить указанные документы и материалы или их копии в письменной форме.
Горячая линия ТО Росздравнадзора (495) 611-47-74; 8(916)256-76-76.
Законодательные акты
1. Закон РФ от 07.02.1992 № 2300-1 «О защите прав потребителей».
2. Федеральный закон от 21.11.2011 № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации».
3. Постановление Правительства РФ от 04.10.2012 № 1006 «Об утверждении Правил предоставления медицинскими организациями платных медицинских услуг».
4. Постановление Правительства РФ от 16.04.2012 № 291 «О лицензировании медицинской деятельности (за исключением указанной деятельности, осуществляемой медицинскими организациями и другими организациями, входящими в частную систему здравоохранения, на территории инновационного центра «Сколково»).
Регламент реагирования на запросы субъектов персональных данных/уполномоченного органа по защите прав субъектов персональных данных и действия работников.
№ п/п | Виды запросов от субъектов персональных данных/уполномоченного органа | Действия работников | Срок для выполнения действий с персональными данными | Срок для ответа и (или) уведомления субъекта персональных данных/уполномоченного органа |
1. | Запрос субъекта персональных данных/ уполномоченного органа о подтверждении обработки персональных данных | Ответ на запрос | Не позднее 30 календарных дней | |
2. | Запрос на ознакомление с персональными данными | Ответ на запрос с датой и указанием времени для возможности ознакомления субъекта со своими персональными данными | Не позднее 30 календарных дней | |
3. | Отзыв согласия на обработку персональных данных | Удалить и уничтожить персональные данные, если иное не предусмотрено договором с субъектом, либо если ООО «Клиника АВС» не вправе осуществлять обработку персональных данных без согласия | Не позднее 30 календарных дней с момента регистрации отзыва |
Заблокировать персональные данные при предоставлении субъектом персональных данных/уполномоченным органом подтверждающих сведений о том, что персональные данные являются неполными, неточными или неактуальными | Не позднее 7 рабочих дней | |||
Уничтожить персональные данные при предоставлении субъектом подтверждающих сведений о том, что персональные данные являются незаконно полученными или не являются необходимыми для заявленной цели обработки | Не позднее 7 рабочих дней | |||
4. | Неправомерная обработка персональных данных субъекта | Прекратить обработку персональных данных с момента получения обращения/запроса субъекта персональных данных/ уполномоченного органа | Не позднее 3 рабочих дней | В течение 10 рабочих дней, если невозможно обеспечить правомерность обработки |
Удалить и уничтожить персональные данные | В течение 10 рабочих дней с момента удаления и уничтожения персональных данных | |||
5. | Достижение целей обработки персональных данных | Удалить и уничтожить персональные данные, если иное не предусмотрено договором с субъектом либо если не вправе осуществлять обработку персональных данных без согласия | В течение 30 календарных дней с момента достижения целей |
Надзор за коронавирусом | US GAO
Обзор
На сегодняшний день мы выпустили 10 всеобъемлющих отчетов о Законе о помощи, помощи и экономической безопасности в связи с коронавирусом (CARES), а также множество других беспристрастных, основанных на фактах отчетов по темам, связанным с пандемией. Мы внесли 350 рекомендаций, 94 из которых были полностью выполнены, и вынесли 18 вопросов на рассмотрение Конгресса. Загрузите электронную таблицу рекомендаций от работы GAO, связанной с COVID, по состоянию на 31 марта 2022 года: Excel Workbook (XLSX, 327 КБ) или Значения, разделенные запятыми (CSV, 120 КБ). Следующий общегосударственный отчет по Закону CARES будет опубликован в апреле 2023 года9.0007
Мы внесли 350 рекомендаций, 94 из которых были полностью выполнены, и вынесли 18 вопросов на рассмотрение Конгресса. Загрузите электронную таблицу рекомендаций от работы GAO, связанной с COVID, по состоянию на 31 марта 2022 года: Excel Workbook (XLSX, 327 КБ) или Значения, разделенные запятыми (CSV, 120 КБ). Следующий общегосударственный отчет по Закону CARES будет опубликован в апреле 2023 года9.0007
Просмотреть все отчеты закона CARES
Поскольку число смертей и серьезных заболеваний в результате пандемии снижается, необходимость повышения готовности страны и усилий по оказанию помощи для будущих пандемий в определенных областях остается важной. GAO дало CDC следующие рекомендации:
- Определить конкретные действия и временные рамки для усилий агентства по модернизации данных в своем стратегическом плане реализации.
- Совместно с соответствующими заинтересованными сторонами разработайте план расширения возможностей лабораторных испытаний.

- Соберите более полные данные о случаях COVID-19, госпитализациях и смертях среди представителей расовых и этнических меньшинств.
Кроме того, выплаты получателям, которые были сделаны по ошибке в крупных программах, таких как страхование по безработице и кредиты для малого бизнеса, потребуют дополнительных сдержек и противовесов. В 2021 финансовом году федеральные агентства допустили платежные ошибки на сумму около 281 миллиарда долларов США, что на 75 миллиардов долларов больше, чем в предыдущем финансовом году, и примерно вдвое превышает сумму, указанную в 2017 финансовом году.
и Бюджет требуют, чтобы агентства подтверждали представленные ими данные о платежах. И для программ экстренного кредитования Администрации малого бизнеса для реализации рекомендаций GAO по укреплению целостности программы и защите от мошенничества. Национальная система страхования по безработице была официально добавлена в наш список высокого риска в июне 2022 года9.0007
Все отчеты о COVID-19
Как получать уведомления о новых отчетах
Будьте первыми, кто узнает, когда GAO опубликует новую работу, связанную с пандемией и надзором за коронавирусом.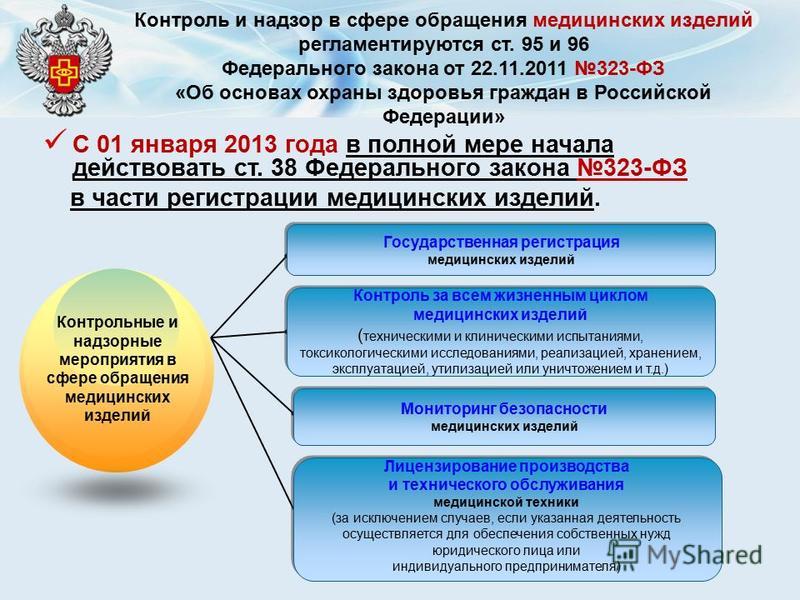
- Прямая трансляция отчетов : Вставьте ленту отчетов на свой веб-сайт.
- Ежедневные электронные письма : Подпишитесь на наши ежедневные электронные письма по этой или некоторым другим темам.
- Twitter : Самый быстрый способ узнать, что мы выпустили новую работу, — это подписаться на нас в Twitter @usgao.
- Открытые рекомендации : отслеживать связанные открытые рекомендации.
- Блог Публикации : Посетите WatchBlog, чтобы прочитать последние сообщения о COVID-19.
- Ранее опубликованная работа по теме: Посмотрите наш раздел, посвященный прошлым отчетам, связанным с пандемией.
Наши опубликованные отчеты и свидетельства Конгресса, имеющие отношение к пандемии коронавируса, доступны ниже. Список будет пополняться новыми отчетами по мере их публикации.
Надзор за коронавирусом
Просмотреть все
Отчеты о надзоре по Закону CARES
Закон CARES от 2020 года требует от GAO выпускать регулярные отчеты о воздействии COVID-19. Мы выпустили серию двухмесячных отчетов, продолжаем выпускать отдельные отчеты, а также начнем ежегодные отчеты в апреле 2023 года. Вы можете просмотреть каждый отчет и его рекомендации здесь:
Мы выпустили серию двухмесячных отчетов, продолжаем выпускать отдельные отчеты, а также начнем ежегодные отчеты в апреле 2023 года. Вы можете просмотреть каждый отчет и его рекомендации здесь:
Программа продовольственной помощи в связи с коронавирусом: Министерство сельского хозяйства США должно проводить более тщательную проверку платежей производителям
GAO-22-104397
Опубликовано: 08 сентября 2022 г.
Публично опубликовано: 08 сентября 2022 г.
COVID-19: текущая и будущая федеральная готовность требует исправлений для улучшения медицинских данных и устранения неправомерных платежей
GAO-22-105397
Опубликовано: 27 апреля 2022 г.
Публично опубликовано: 27 апреля 2022 г.
COVID-19: необходимы значительные улучшения для надзора за фондами помощи и руководства реагированием на чрезвычайные ситуации в области общественного здравоохранения
GAO-22-105291
Опубликовано: 27 января 2022 г.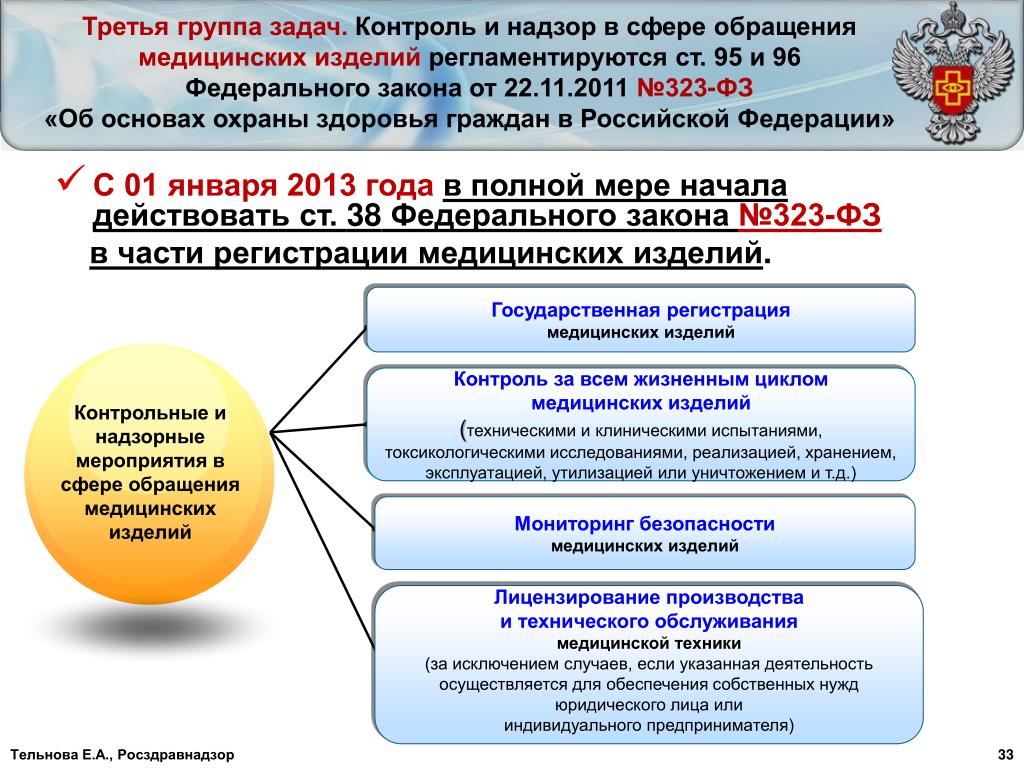
Публично опубликовано: 27 января 2022 г.
COVID-19: необходимы дополнительные действия для повышения подотчетности и эффективности программы федерального реагирования
GAO-22-105051
Опубликовано: 27 октября 2021 г.
Публично опубликовано: 27 октября 2021 г.
COVID-19: необходимо постоянное внимание для повышения федеральной готовности, реагирования, предоставления услуг и целостности программы
GAO-21-551
Опубликовано: 19 июля 2021 г.
Публично опубликовано: 19 июля 2021 г.
COVID-19: устойчивые действия федерального правительства имеют решающее значение, поскольку пандемия продолжается уже второй год
GAO-21-387
Опубликовано: 31 марта 2021 г.
Публично опубликовано: 31 марта 2021 г.
COVID-19: распределение важнейших вакцин, цепочка поставок, целостность программы и другие проблемы требуют пристального внимания со стороны федерального правительства
GAO-21-265
Опубликовано: 28 января 2021 г.
Публично опубликовано: 28 января 2021 г.
COVID-19: необходимы срочные действия для лучшего обеспечения эффективного реагирования на федеральном уровне
GAO-21-191
Опубликовано: 30 ноября 2020 г.
Публично опубликовано: 30 ноября 2020 г.
COVID-19: федеральные усилия ускоряют разработку вакцин и терапевтических средств, но требуется больше прозрачности в отношении разрешений на использование в чрезвычайных ситуациях
GAO-21-207
Опубликовано: 17 ноября 2020 г.
Публично опубликовано: 17 ноября 2020 г.
COVID-19: федеральные усилия могут быть подкреплены своевременными и согласованными действиями
GAO-20-701
Опубликовано: 21 сентября 2020 г.
Публично опубликовано: 21 сентября 2020 г.
COVID-19: краткий обзор первоначальных федеральных мер реагирования на пандемию
GAO-20-708
Опубликовано: 31 августа 2020 г.
Публичный выпуск: 31 августа 2020 г.
Covid-19: возможности для улучшения федеральных мер реагирования и восстановления
GAO-20-625
Опубликовано: 25 июня 2020 г.
Публично опубликовано: 25 июня 2020 г.
Загрузить все
Сообщить о предполагаемом мошенничестве в GAO
ИзображениеФедеральные агентства несут ответственность за то, чтобы все средства из рекордного пакета стимулирующих мер на сумму 2 триллиона долларов оказались там, где они должны быть. GAO было поручено отслеживать эти деньги. Если вы подозреваете растрату, мошенничество или злоупотребление стимулирующими средствами, вы можете помочь нам, используя FraudNet, чтобы сообщить о своих опасениях. Читайте пресс-релиз от 10 апреля.
Сообщить о мошенничестве
FraudNet и Федеральная помощь COVID-19
Стенограмма
FraudNet — это программа GAO, позволяющая общественности, государственным служащим и подрядчикам сообщать о заявлениях о неправомерных действиях федерального правительства, включая мошенничество, растрату или злоупотребление средствами, предоставленными в соответствии с Законом CARES.
Контакты и ресурсы
GAO Контакты
Джессика Фарб
Управляющий директор
(202) 512-7114
Загружаемые ресурсы
- Просмотреть сводку (PDF, 2 страницы) о работе с COVID-19, которую мы проделали по состоянию на март 2022 года.
- Загрузите электронную таблицу с рекомендациями из работы GAO, связанной с COVID, по состоянию на 31 марта 2022 г.: рабочая книга Excel (XLSX, 327 КБ) или значения, разделенные запятыми (CSV, 120 КБ).
Внешние федеральные ресурсы, связанные с коронавирусом (COVID-19)
- Coronavirus.gov: общедоступная информация, предоставленная правительством США в связи с коронавирусной болезнью (COVID-19) .
- CDC Coronavirus Disease 2019 (COVID-19): актуальная информация о общественном здравоохранении и безопасности при COVID-19.
- USA.gov Коронавирус: что делает правительство США в ответ на коронавирус (COVID-19).
 Просмотр на испанском языке.
Просмотр на испанском языке.
Федеральный отчет о тестировании на COVID-19: анализ данных из шести федеральных программ здравоохраненияиспытания шестью федеральными организациями.
В своем обзоре для CNN от 9 апреля 2021 г. председатель PRAC Майкл Горовиц и Кристи Гримм из HHS OIG излагают четыре важных урока для улучшения тестирования на COVID-19. В этом отчете рассматриваются усилия по тестированию COVID-19 в шести федеральных программах здравоохранения в течение первых семи месяцев после объявления чрезвычайной ситуации в области общественного здравоохранения в Соединенных Штатах. В отчете, опубликованном подгруппой PRAC Health Care Subgroup, подробно рассматриваются данные тестирования в каждой из программ, которые в совокупности предоставляют льготы или уход примерно 64 миллионам человек. Мы надеемся, что этот отчет поможет разработчикам политики, поскольку они продолжают развивать и совершенствовать свои усилия по тестированию, связанные с доступностью и доступностью тестирования для групп риска, экономической эффективностью и достаточным количеством доступных данных для обоснования усилий по тестированию.
Получите все подробности и идеи в Федеральном отчете о тестировании на COVID-19 : анализ данных шести федеральных программ здравоохранения .
Между 1 февраля 2020 г. и 31 августа 2020 г. шесть федеральных программ здравоохранения, администрируемых или оплачиваемых
10,7 миллиона
Тесты на COVID-19, представляющие
12,7% всех тестов
, проведенных в Соединенных Штатах.
Подгруппа PRAC Health Care состоит из офисов генеральных инспекторов (OIG), которые контролируют предоставление федеральными агентствами медицинских услуг или их возмещение. Эти OIG работают вместе и обмениваются данными для обеспечения скоординированного надзора между агентствами и программами.
Подгруппа задала следующие вопросы всем шести агентствам:
- Сколько тестов на COVID-19 было проведено и когда?
- Кого тестировали?
- Какие типы тестов были проведены?
- Сколько каждая программа здравоохранения заплатила за анализы?
- В каких медицинских учреждениях люди получали доступ к тестированию?
- Сколько времени потребовалось для возврата результатов теста?
Статистика
- Федеральное возмещение расходов на тесты на вирус COVID-19 варьировалось в зависимости от программ.

- Тенденции тестирования на COVID-19 в основном следовали той же схеме, что и национальные тенденции тестирования с февраля по август 2020 года.
- Большинство программ тестирования на COVID-19, проводимых или оплачиваемых, представляли собой тесты на вирусы, которые выявляют текущие инфекции SARS-CoV-2 и выявляют тех, кто может передавать вирус.
- Доступная информация о сроках выполнения теста на COVID-19 была доступна только в трех программах, проводивших тесты; двое из трех сообщили, что время обработки тестов со временем уменьшилось.
- Что касается пола, возраста, расы или этнической принадлежности, тестирование федеральных бенефициаров, как правило, было пропорционально демографическим характеристикам населения, которое обслуживали две программы; остальные четыре программы имели различные уровни доступной демографической информации.
Приложение 1: Федеральные программы здравоохранения, рассматриваемые в этом отчете, и группы населения, которые они обслуживают.
| Программы здравоохранения, которые обрабатывают заявления и оплата за тестирование на COVID-19 | Программы здравоохранения, которые предоставляют тестирование на COVID-19 в учреждениях, которыми они управляют или управляют | |||||
| Агентство | HHS | ОПМ | ДОЛ | ВА | Минобороны | Министерство юстиции |
| Федеральная программа здравоохранения | Medicare Часть B | Программа медицинского страхования федеральных служащих (FEHBP) | Управление программы компенсации работникам | Управление здравоохранения ветеранов | Лечебные учреждения | Бюро тюрем |
| Обслуживаемое население* | 38,9 млн взрослых в возрасте 65 лет и старше, а также лиц с терминальной стадией почечной недостаточности и лиц с соответствующей инвалидностью | 6,2 миллиона федеральных служащих, пенсионеров и имеющих право членов семьи зарегистрированы в двух крупнейших перевозчиках FEHBP | Более 223 000 федеральных служащих, подавших заявки на компенсацию работникам; нынешние или бывшие работники и подрядчики Министерства энергетики; и бывшие шахтеры и их выжившие иждивенцы | 9 миллионов зачисленных ветеранов, сотрудников и других лиц, не являющихся ветеранами, которые соответствуют определенным критериям | 9,6 млн военнослужащих и членов их семей | Более 218 000 федеральных заключенных, приписанных к федеральным тюрьмам, находящимся в ведении Бюро тюрем; контрактные тюрьмы; и жилые центры повторного въезда (также известные как дома на полпути) |
| Количество людей, прошедших хотя бы один тест на COVID-19 | 5 090 175 | 473 440 | 1 098 | 553 687 | 319 674 | 66 587 |
*Подробное описание населения, которое обслуживает каждая программа, см.

 02.2022 N 67096)
02.2022 N 67096) 02.2016 N 09-С-571-1414″
02.2016 N 09-С-571-1414″


 Просмотр на испанском языке.
Просмотр на испанском языке.